الجدول الدوري للعناصر الكيميائية هو قائمة بالعناصر المعروفة. في الجدول ، يتم ترتيب العناصر بترتيب الأعداد الذرية بدءًا من أقل عدد. العدد الذري لعنصر ما هو نفسه عدد البروتونات في تلك الذرة المعينة.
حصل ديمتري مندليف على الفضل في تصميم الجدول الدوري الحديث.
كل عنصر له مربع في الجدول الدوري. هناك 3 أجزاء من المعلومات في كل مربع
- اسم العنصر
- رمزها الكيميائي الرسمي
- عددها الذري
على سبيل المثال ، سيبدو مربع الحديد مثل هذا قليلاً:
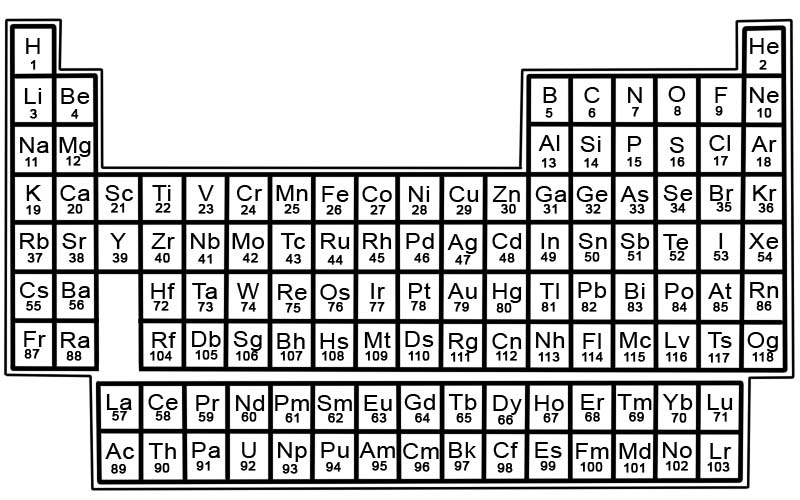
العناصر الموجودة في الجدول الدوري مرتبة في صفوف وأعمدة.
- تسمى الصفوف بالنقاط . الفترة هي صف من العناصر في الجدول الدوري تتغير خصائصها تدريجيًا وبشكل متوقع.
- تسمى الأعمدة المجموعات. يحتوي الجدول الدوري على 18 عمودًا من العناصر. يحتوي كل عمود على مجموعة أو عائلة من العناصر. تحتوي المجموعة على عناصر لها خصائص فيزيائية أو كيميائية متشابهة.
المناطق في الجدول الدوري
يمكن تقسيم الجدول الدوري إلى أقسام.
يتكون قسم واحد من أول مجموعتين ، المجموعة 1 و 2 ، والعناصر في المجموعات 3-18. هذه هي العناصر التمثيلية. وهي تشمل المعادن والفلزات واللافلزات.
المعادن
أمثلة: الحديد والقصدير والصوديوم والبلوتونيوم.
- عادة صلبة في درجة حرارة الغرفة (الزئبق استثناء)
- لمعان عالي (لامع)
- مظهر معدني
- موصلات جيدة للحرارة والكهرباء
- مرن (يمكن ثنيه وقصفه إلى صفائح رقيقة)
- مطيل (يمكن سحبه في سلك)
- تتآكل أو تتأكسد في الهواء ومياه البحر
- عادة ما تكون كثيفة (تشمل الاستثناءات الليثيوم والبوتاسيوم والصوديوم)
- قد يكون لها درجة انصهار عالية جدًا
- تفقد الإلكترونات بسهولة
الفلزات
أمثلة: البورون والسيليكون والزرنيخ.
- باهتة أو لامعة
- عادة ما توصل الحرارة والكهرباء ، ولكن ليس مثل المعادن
- غالبًا ما تصنع أشباه موصلات جيدة
- غالبًا ما توجد في عدة أشكال
- في كثير من الأحيان مطيل
- غالبًا ما تكون مرنة
- قد تكتسب أو تفقد إلكترونات في التفاعلات
اللافلزات
أمثلة: الأكسجين والكلور والأرجون.
- مظهر باهت
- عادة هشة
- الموصلات السيئة للحرارة والكهرباء
- عادة أقل كثافة ، مقارنة بالمعادن
- عادة ما تكون نقطة انصهار منخفضة للمواد الصلبة ، مقارنة بالمعادن
- تميل إلى اكتساب الإلكترونات في التفاعلات الكيميائية
المجموعات 1 و 2
- المجموعة 1 - الفلزات القلوية. أمثلة: الصوديوم والليثيوم والبوتاسيوم.
- المجموعة 2 - المعادن الأرضية القلوية أمثلة: البريليوم والمغنيسيوم والكالسيوم والباريوم والراديوم. كل معدن أرضي قلوي أكثر كثافة وصلابة وله نقطة انصهار أعلى من المعدن القلوي في نفس الفترة. الفلزات القلوية الأرضية تفاعلية ولكنها ليست تفاعلية مثل الفلزات القلوية.
المجموعات من 13 إلى 18
المجموعة 13 - عائلة البورون
- أمثلة: البورون (ب) والألمنيوم (آل) والغاليوم (جا) والإنديوم (إن) والثاليوم (تل).
- لديهم ثلاثة إلكترونات تكافؤ.
المجموعة 14 - عائلة الكربون
- أمثلة: الكربون (C) والسيليكون (Si) والجرمانيوم (Ge) والقصدير (Sn) والرصاص (Pb).
- لديهم جميعًا أربعة إلكترونات تكافؤ.
المجموعة 15 - عائلة النيتروجين
- أمثلة: النيتروجين (N) ، الفوسفور (P) ، الزرنيخ (As) ، الأنتيمون (Sb) ، والبزموت (Bi).
- كل هذه العناصر لها خمسة إلكترونات تكافؤ.
- النيتروجين والفوسفور من غير المعادن.
المجموعة 16 - عائلة الأكسجين
- أمثلة: الأكسجين (O) ، والكبريت (S) ، والسيلينيوم (Se) ، والتيلوريوم (Te) ، والبولونيوم المشع (Po).
- تحتوي هذه المجموعة على ستة إلكترونات تكافؤ
- تُعرف هذه أيضًا باسم chalcogens.
المجموعة 17 - الهالوجينات
- أمثلة: الفلور (F) والكلور (Cl) والبروم (Br) واليود (I) والأستاتين (At).
- لديهم سبعة إلكترونات تكافؤ.
- هذه المجموعة هي أول مجموعة تتكون من غير فلزات بالكامل.
- الهالوجينات شديدة التفاعل ، وبالتالي يمكن أن تكون ضارة أو مميتة للكائنات البيولوجية بكميات كافية.
- غالبًا ما يستخدم الرمز X بشكل عام للإشارة إلى أي هالوجين.
- اسم "هالوجين" يعني "إنتاج الملح". عندما تتفاعل الهالوجينات مع المعادن فإنها تنتج مجموعة واسعة من الأملاح ، بما في ذلك الكالسيوم والفلوريد وكلوريد الصوديوم (ملح الطعام) وبروميد الفضة ويوديد البوتاسيوم.
المجموعة 18 - الغازات النبيلة
- هناك ستة غازات نبيلة - الهيليوم والنيون والأرجون والكريبتون والزينون والرادون.
- كلها غازات موجودة في الهواء. تشكل حوالي 0.96٪ من الغلاف الجوي.
- كلهم أحادي الذرة ، مما يعني أن كل جزيء هو ذرة واحدة.
- يكاد لا يتفاعلون أبدًا مع العناصر الأخرى. هذا لأن لديهم غلاف إلكترون خارجي كامل مكون من 8 إلكترونات.
- تحتوي الغازات النبيلة على نقاط غليان وانصهار منخفضة للغاية ، مما يجعلها مفيدة كمبردات مبردة.
المعادن الانتقالية
- العناصر في المجموعات 3-12 هي عناصر انتقالية.
- كلهم معادن.
- تم العثور على معظم عناصر الانتقال مدمجة مع عناصر أخرى في الخامات.
- تم العثور على بعض العناصر الانتقالية مثل الذهب والفضة كعناصر نقية.
- تتكون خيوط المصابيح الكهربائية من التنجستن (العنصر 74) الذي يتمتع بأعلى نقطة انصهار من أي معدن ولن يذوب عند مرور تيار من خلاله.
- يستخدم الزئبق ، الذي يحتوي على أقل نقطة انصهار من أي معدن ، في موازين الحرارة والبارومترات.
- الزئبق هو المعدن الوحيد الذي يكون سائلاً في درجات حرارة الغرفة.
ثالوث الحديد
ثلاثة عناصر في المجموعة 4 - الحديد والكوبالت والنيكل - لها خصائص مماثلة تُعرف باسم ثالوث الحديد.
المجموعة البلاتينية
يُطلق أحيانًا على الروثينيوم والروديوم والبلاديوم والأوزميوم والإيريديوم والبلاتين مجموعة البلاتين لأن لها خصائص متشابهة. لا تتحد بسهولة مع العناصر الأخرى. نتيجة لذلك ، يمكن استخدامها كمحفزات.
عناصر الانتقال الداخلية
يتم وضع بعض عناصر الانتقال ، التي تسمى عناصر الانتقال الداخلية ، أسفل الجدول الرئيسي. تسمى هذه العناصر سلسلة اللانثانيد والأكتينيد لأن سلسلة واحدة تتبع عنصر اللانثانم ، والعنصر 57 ، والسلسلة الأخرى تتبع الأكتينيوم ، العنصر 89.
اللانثانيدات - السلسلة الأولى ، من السيريوم إلى اللوتيتيوم ، تسمى اللانثانيدات. يُطلق على اللانثانيدات أيضًا اسم الأرض النادرة لأنه كان يُعتقد في وقت ما أنها نادرة. إنها معادن ناعمة يمكن قطعها بسكين.
الأكتينيدات - جميع الأكتينيدات مشعة. الثوريوم والبروتكتينيوم واليورانيوم هي الأكتينيدات الوحيدة الموجودة الآن بشكل طبيعي على الأرض. جميع الأكتينيدات الأخرى هي عناصر اصطناعية. يتم تصنيع العناصر الاصطناعية في المعامل والمفاعلات النووية.
