Kimyəvi elementlərin dövri cədvəli məlum elementlərin siyahısıdır. Cədvəldə elementlər ən aşağı nömrədən başlayaraq atom nömrələri sırasına görə yerləşdirilib. Elementin atom nömrəsi həmin atomdakı protonların sayı ilə eynidir.
Dmitri Mendeleyev müasir dövri cədvəli tərtib etmək üçün kredit alır.
Hər bir elementin dövri cədvəldə kvadratı var. Hər kvadratda 3 ədəd məlumat var
- elementin adı
- onun rəsmi kimyəvi simvolu
- onun atom nömrəsi
Məsələn, dəmir üçün kvadrat bir az belə görünəcək:
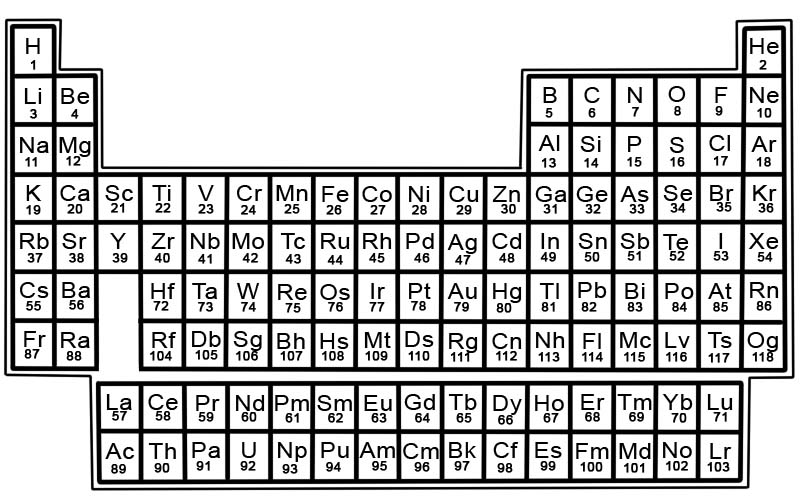
Dövri cədvəldəki elementlər sətir və sütunlarda düzülür.
- Sətirlərə dövrlər deyilir. Dövr, dövri cədvəldə xassələri tədricən və proqnozlaşdırıla bilən şəkildə dəyişən elementlər sırasıdır.
- Sütunlara qruplar deyilir. Dövri cədvəldə 18 element sütunu var. Hər bir sütun elementlər qrupunu və ya ailəsini ehtiva edir. Qrup oxşar fiziki və ya kimyəvi xassələrə malik elementləri ehtiva edir.
Dövri cədvəldəki zonalar
Dövri cədvəli bölmələrə bölmək olar.
Bir bölmə ilk iki qrupdan, 1-ci və 2-ci qrupdan və 3-18-ci qruplardakı elementlərdən ibarətdir. Bunlar təmsilçi elementlərdir. Bunlara metallar, metaloidlər və qeyri-metallar daxildir.
Metallar
Nümunələr: dəmir, qalay, natrium və plutonium.
- adətən otaq temperaturunda bərk (civə istisnadır)
- yüksək parıltı (parlaq)
- metal görünüş
- yaxşı istilik və elektrik keçiriciləri
- elastik (əyilmiş və nazik təbəqələrə döyülə bilər)
- çevik (tellə çəkilə bilər)
- havada və dəniz suyunda paslanır və ya oksidləşir
- adətən sıx (istisnalara litium, kalium və natrium daxildir)
- çox yüksək ərimə nöqtəsinə malik ola bilər
- elektronları asanlıqla itirir
Metalloidlər
Nümunələr: bor, silisium və arsen.
- tutqun və ya parlaq
- metallar kimi olmasa da, adətən istilik və elektrik cərəyanını keçirir
- tez-tez yaxşı yarımkeçiricilər hazırlayır
- çox vaxt bir neçə formada mövcuddur
- tez-tez çevik
- tez-tez elastikdir
- reaksiyalarda elektron qazana və ya itirə bilər
Qeyri-metallar
Nümunələr: oksigen, xlor və arqon.
- darıxdırıcı görünüş
- adətən kövrək olur
- istilik və elektrik enerjisinin zəif keçiriciləri
- adətən metallarla müqayisədə daha az sıx olur
- metallarla müqayisədə bərk maddələrin adətən aşağı ərimə nöqtəsi
- kimyəvi reaksiyalarda elektron qazanmağa meyllidirlər
Qrup 1 və 2
- Qrup 1 - Qələvi metallar. Nümunələr: natrium, litium və kalium.
- Qrup 2 - Qələvi torpaq metalları Nümunələr: berilyum, maqnezium, kalsium, barium və radium. Hər bir qələvi torpaq metalı daha sıx və daha sərtdir və eyni dövrdə qələvi metaldan daha yüksək ərimə nöqtəsinə malikdir. Qələvi torpaq metalları reaktivdir, lakin qələvi metallar kimi reaktiv deyil.
13-18 qruplar
Qrup 13 – Bor ailəsi
- Nümunələr: bor (B), alüminium (Al), qalium (Ga), indium (In) və tallium (Tl).
- Onların üç valent elektronu var.
Qrup 14 – Karbon ailəsi
- Nümunələr: karbon (C), silisium (Si), germanium (Ge), qalay (Sn) və qurğuşun (Pb).
- Onların hamısının dörd valent elektronu var.
Qrup 15 – Azot ailəsi
- Nümunələr: azot (N), fosfor (P), arsen (As), antimon (Sb) və vismut (Bi).
- Bu elementlərin hamısının beş valent elektronu var.
- Azot və fosfor qeyri-metallardır.
Qrup 16 - Oksigen ailəsi
- Nümunələr: oksigen (O), kükürd (S), selenium (Se), tellur (Te) və radioaktiv polonium (Po).
- Bu qrup altı valent elektrona malikdir
- Bunlara xalkogenlər də deyilir.
Qrup 17 – Halogenlər
- Nümunələr: flüor (F), xlor (Cl), brom (Br), yod (I) və astatin (At).
- Onların yeddi valent elektronu var.
- Bu qrup tamamilə qeyri-metallardan ibarət olan ilk qrupdur.
- Halojenlər yüksək reaktivdir və beləliklə, kifayət qədər miqdarda bioloji orqanizmlər üçün zərərli və ya öldürücü ola bilər.
- X simvolu tez-tez hər hansı bir halogenə istinad etmək üçün ümumi olaraq istifadə olunur.
- "Halojen" adı "duz istehsal edən" deməkdir. Halojenlər metallarla reaksiyaya girdikdə, kalsium, ftorid, natrium xlorid (süfrə duzu), gümüş bromid və kalium yodid də daxil olmaqla geniş çeşiddə duzlar əmələ gətirirlər.
Qrup 18 - Nəcib qazlar
- Altı nəcib qaz var - helium, neon, arqon, kripton, ksenon və radon.
- Onların hamısı qazdır və havada olur. Onlar atmosferin təxminən 0,96%-ni təşkil edir.
- Onların hamısı monoatomikdir, yəni hər bir molekul tək bir atomdur.
- Onlar demək olar ki, heç vaxt digər elementlərlə reaksiya vermirlər. Bunun səbəbi onların tam 8 elektron xarici elektron qabığa malik olmasıdır.
- Nəcib qazların çox aşağı qaynama və ərimə nöqtələri var ki, bu da onları kriogen soyuducu kimi faydalı edir.
Keçid metalları
- 3-12-ci qruplardakı elementlər keçid elementləridir.
- Onların hamısı metaldır.
- Keçid elementlərinin əksəriyyəti filizlərdə digər elementlərlə birləşərək tapılır.
- Qızıl və gümüş kimi bir neçə keçid elementi təmiz elementlər kimi tapılır.
- Lampaların filamentləri istənilən metalın ən yüksək ərimə nöqtəsinə malik volframdan (element 74) hazırlanır və cərəyan keçdikdə əriməyəcək.
- Hər hansı metalın ən aşağı ərimə nöqtəsinə malik olan civə termometrlərdə və barometrlərdə istifadə olunur.
- Merkuri otaq temperaturunda maye halında olan yeganə metaldır.
Dəmir üçlüyü
4-cü qrupdakı üç element - dəmir, kobalt və nikel - o qədər oxşar xüsusiyyətlərə malikdir ki, onlar dəmir triadası kimi tanınır.
Platin qrupu
Rutenium, rodium, palladium, osmium, iridium və platin oxşar xüsusiyyətlərə malik olduqları üçün bəzən platin qrupu adlanır. Digər elementlərlə asanlıqla birləşmirlər. Nəticədə, onlar katalizator kimi istifadə edilə bilər.
Daxili keçid elementləri
Daxili keçid elementləri adlanan bəzi keçid elementləri əsas cədvəlin altında yerləşdirilir. Bu elementlər lantanid və aktinid seriyası adlanır, çünki bir sıra lantan elementi, element 57, digər sıra isə aktinium, element 89-dan sonra gəlir.
Lantanidlər - Seriumdan lutetiuma qədər olan ilk seriya lantanidlər adlanır. Lantanidlər də nadir torpaq adlanır, çünki bir vaxtlar onların az olduğu düşünülürdü. Onlar bıçaqla kəsilə bilən yumşaq metallardır.
Aktinidlər - Bütün aktinidlər radioaktivdir. Torium, protaktinium və uran hazırda Yerdə təbii olaraq tapılan yeganə aktinidlərdir. Bütün digər aktinidlər sintetik elementlərdir. Sintetik elementlər laboratoriyalarda və nüvə reaktorlarında hazırlanır.
