রাসায়নিক উপাদানগুলির পর্যায় সারণী হল পরিচিত উপাদানগুলির একটি তালিকা। টেবিলে, উপাদানগুলিকে সর্বনিম্ন সংখ্যা দিয়ে শুরু করে তাদের পারমাণবিক সংখ্যার ক্রমে স্থাপন করা হয়। একটি মৌলের পারমাণবিক সংখ্যা সেই নির্দিষ্ট পরমাণুর প্রোটনের সংখ্যার সমান।
দিমিত্রি মেন্ডেলিভ আধুনিক পিরিয়ডিক টেবিল ডিজাইন করার কৃতিত্ব পান।
পর্যায় সারণিতে প্রতিটি উপাদানের একটি বর্গ থাকে। প্রতিটি স্কোয়ারে 3 টুকরো তথ্য রয়েছে
- উপাদানটির নাম
- এর সরকারী রাসায়নিক প্রতীক
- এর পারমাণবিক সংখ্যা
উদাহরণস্বরূপ, লোহার বর্গক্ষেত্রটি কিছুটা এইরকম দেখাবে:
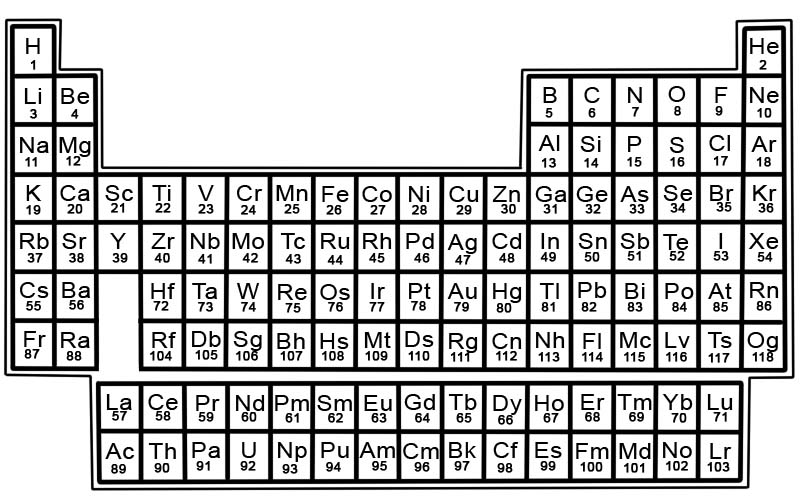
পর্যায় সারণির উপাদানগুলি সারি এবং কলামে সাজানো।
- সারিগুলিকে পিরিয়ড বলা হয়। পিরিয়ড হল পর্যায় সারণির উপাদানগুলির একটি সারি যার বৈশিষ্ট্যগুলি ধীরে ধীরে এবং পূর্বাভাস অনুযায়ী পরিবর্তিত হয়।
- কলামগুলিকে গ্রুপ বলা হয়। পর্যায় সারণীতে উপাদানগুলির 18 টি কলাম রয়েছে। প্রতিটি কলামে উপাদানগুলির একটি গ্রুপ বা পরিবার রয়েছে। একটি গ্রুপে এমন উপাদান থাকে যার অনুরূপ শারীরিক বা রাসায়নিক বৈশিষ্ট্য রয়েছে।
পর্যায় সারণিতে অঞ্চল
পর্যায় সারণিকে ভাগে ভাগ করা যায়।
একটি বিভাগে প্রথম দুটি গ্রুপ, গ্রুপ 1 এবং 2, এবং 3-18 গ্রুপের উপাদান রয়েছে। এগুলি প্রতিনিধিত্বমূলক উপাদান। এর মধ্যে রয়েছে ধাতু, ধাতব পদার্থ এবং অধাতু।
ধাতু
উদাহরণ: লোহা, টিন, সোডিয়াম এবং প্লুটোনিয়াম।
- সাধারণত ঘরের তাপমাত্রায় কঠিন (পারদ একটি ব্যতিক্রম)
- উচ্চ দীপ্তি (চকচকে)
- ধাতব চেহারা
- তাপ এবং বিদ্যুতের ভাল পরিবাহী
- নমনীয় (বাঁকানো এবং পাতলা চাদরে ঠেলে দেওয়া যেতে পারে)
- নমনীয় (তারে আঁকা যায়)
- বায়ু এবং সমুদ্রের জলে ক্ষয় বা জারণ
- সাধারণত ঘন (ব্যতিক্রমগুলি লিথিয়াম, পটাসিয়াম এবং সোডিয়াম অন্তর্ভুক্ত)
- একটি খুব উচ্চ গলনাঙ্ক হতে পারে
- সহজেই ইলেকট্রন হারায়
ধাতব পদার্থ
উদাহরণ: বোরন, সিলিকন এবং আর্সেনিক।
- নিস্তেজ বা চকচকে
- সাধারণত তাপ এবং বিদ্যুৎ পরিচালনা করে, যদিও ধাতু নয়
- প্রায়শই ভাল সেমিকন্ডাক্টর তৈরি করে
- প্রায়শই বিভিন্ন রূপে বিদ্যমান
- প্রায়ই নমনীয়
- প্রায়ই নমনীয়
- বিক্রিয়ায় ইলেকট্রন লাভ বা হারাতে পারে
অ ধাতু
উদাহরণ: অক্সিজেন, ক্লোরিন এবং আর্গন।
- নিস্তেজ চেহারা
- সাধারণত ভঙ্গুর
- তাপ এবং বিদ্যুতের দুর্বল পরিবাহী
- ধাতুর তুলনায় সাধারণত কম ঘন
- ধাতুর তুলনায় সাধারণত কঠিন দ্রব্যের গলনাঙ্ক কম থাকে
- রাসায়নিক বিক্রিয়ায় ইলেকট্রন লাভের প্রবণতা
গ্রুপ 1 এবং 2
- গ্রুপ 1 - ক্ষার ধাতু। উদাহরণ: সোডিয়াম, লিথিয়াম এবং পটাসিয়াম।
- গ্রুপ 2 - ক্ষারীয় পৃথিবীর ধাতু উদাহরণ: বেরিলিয়াম, ম্যাগনেসিয়াম, ক্যালসিয়াম, বেরিয়াম এবং রেডিয়াম। প্রতিটি ক্ষারীয় পৃথিবী ধাতু ঘন এবং শক্ত এবং একই সময়ের ক্ষার ধাতুর চেয়ে উচ্চতর গলনাঙ্ক। ক্ষারীয় পৃথিবী ধাতু প্রতিক্রিয়াশীল কিন্তু ক্ষার ধাতুর মত প্রতিক্রিয়াশীল নয়।
গ্রুপ 13 থেকে 18
গ্রুপ 13 - বোরন পরিবার
- উদাহরণ: বোরন (বি), অ্যালুমিনিয়াম (আল), গ্যালিয়াম (গা), ইন্ডিয়াম (ইন) এবং থ্যালিয়াম (টিএল)।
- তাদের তিনটি ভ্যালেন্স ইলেকট্রন আছে।
গ্রুপ 14 - কার্বন পরিবার
- উদাহরণ: কার্বন (C), সিলিকন (Si), জার্মেনিয়াম (Ge), টিন (Sn), এবং সীসা (Pb)।
- তাদের সবার চারটি ভ্যালেন্স ইলেকট্রন রয়েছে।
গ্রুপ 15 - নাইট্রোজেন পরিবার
- উদাহরণ: নাইট্রোজেন (এন), ফসফরাস (পি), আর্সেনিক (এএস), অ্যান্টিমনি (এসবি) এবং বিসমুথ (দ্বি)।
- এই সব উপাদানের পাঁচটি ভ্যালেন্স ইলেকট্রন আছে।
- নাইট্রোজেন এবং ফসফরাস অ ধাতু।
গ্রুপ 16 - অক্সিজেন পরিবার
- উদাহরণ: অক্সিজেন (O), সালফার (S), সেলেনিয়াম (Se), টেলুরিয়াম (Te), এবং তেজস্ক্রিয় পোলোনিয়াম (Po)।
- এই গ্রুপে ছয়টি ভ্যালেন্স ইলেকট্রন রয়েছে
- এগুলি ক্যালকোজেন নামেও পরিচিত।
গ্রুপ 17 - হ্যালোজেন
- উদাহরণ: ফ্লোরিন (F), ক্লোরিন (Cl), ব্রোমিন (Br), আয়োডিন (I), এবং Astatine (At)।
- তাদের সাতটি ভ্যালেন্স ইলেকট্রন আছে।
- এই গ্রুপটি সম্পূর্ণরূপে অ-ধাতু নিয়ে গঠিত।
- হ্যালোজেন অত্যন্ত প্রতিক্রিয়াশীল, এবং যেমন পর্যাপ্ত পরিমাণে জৈবিক জীবের জন্য ক্ষতিকারক বা প্রাণঘাতী হতে পারে।
- প্রতীক X প্রায়ই কোন হ্যালোজেন উল্লেখ করার জন্য সাধারণভাবে ব্যবহৃত হয়।
- "হ্যালোজেন" নামের অর্থ "লবণ উৎপাদনকারী"। যখন হ্যালোজেন ধাতুর সাথে বিক্রিয়া করে তখন তারা ক্যালসিয়াম, ফ্লোরাইড, সোডিয়াম ক্লোরাইড (টেবিল লবণ), সিলভার ব্রোমাইড এবং পটাসিয়াম আয়োডাইড সহ বিস্তৃত লবণ উৎপন্ন করে।
গ্রুপ 18 - মহৎ গ্যাস
- ছয়টি মহৎ গ্যাস রয়েছে - হিলিয়াম, নিয়ন, আর্গন, ক্রিপটন, জেনন এবং রেডন।
- এগুলি সব গ্যাস এবং বাতাসে পাওয়া যায়। তারা বায়ুমণ্ডলের প্রায় 0.96% তৈরি করে।
- এরা সবাই একঘেয়েমি, মানে প্রতিটি অণু একটি একক পরমাণু।
- তারা প্রায়ই অন্যান্য উপাদানের সাথে প্রতিক্রিয়া জানায় না। এর কারণ হল তাদের একটি সম্পূর্ণ 8 ইলেকট্রন বাইরের ইলেক্ট্রন শেল রয়েছে।
- নোবেল গ্যাসগুলির খুব কম ফুটন্ত এবং গলনাঙ্ক রয়েছে, যা তাদের ক্রায়োজেনিক রেফ্রিজারেন্ট হিসাবে দরকারী করে তোলে।
অবস্থান্তর ধাতু
- গ্রুপ 3-12 এর উপাদানগুলি হল রূপান্তর উপাদান।
- এরা সবাই ধাতু।
- আকরিকের অন্যান্য উপাদানের সাথে মিলিত হয়ে বেশিরভাগ স্থানান্তর উপাদান পাওয়া যায়।
- কিছু রূপান্তর উপাদান যেমন সোনা এবং রূপা বিশুদ্ধ উপাদান হিসেবে পাওয়া যায়।
- আলোর বাল্বের ফিলামেন্টগুলি টংস্টেন (উপাদান 74) দিয়ে তৈরি যা কোন ধাতুর সর্বোচ্চ গলনাঙ্ক এবং এটির মধ্য দিয়ে কারেন্ট প্রবাহিত হলে গলে যাবে না।
- বুধ, যা কোন ধাতুর সর্বনিম্ন গলনাঙ্ক, থার্মোমিটার এবং ব্যারোমিটারে ব্যবহৃত হয়।
- বুধ একমাত্র ধাতু যা ঘরের তাপমাত্রায় তরল।
আয়রন ট্রায়াড
গ্রুপ 4 এর তিনটি উপাদান - লোহা, কোবাল্ট এবং নিকেল - এর অনুরূপ বৈশিষ্ট্য রয়েছে যেগুলি লোহার ট্রায়াড নামে পরিচিত।
প্লাটিনাম গ্রুপ
রুথেনিয়াম, রোডিয়াম, প্যালাডিয়াম, অসমিয়াম, ইরিডিয়াম এবং প্লাটিনামকে কখনও কখনও প্ল্যাটিনাম গ্রুপ বলা হয় কারণ তাদের একই ধরনের বৈশিষ্ট্য রয়েছে। তারা সহজেই অন্যান্য উপাদানের সাথে একত্রিত হয় না। ফলস্বরূপ, তারা অনুঘটক হিসাবে ব্যবহার করা যেতে পারে।
অভ্যন্তরীণ রূপান্তর উপাদান
কিছু ট্রানজিশন এলিমেন্ট, যাকে বলা হয় ভিতরের ট্রানজিশন এলিমেন্ট, মূল টেবিলের নিচে রাখা হয়। এই উপাদানগুলিকে ল্যান্থানাইড এবং অ্যাক্টিনাইড সিরিজ বলা হয় কারণ একটি সিরিজ উপাদান ল্যান্থানাম, উপাদান 57 এবং অন্য সিরিজটি অ্যাক্টিনিয়াম, উপাদান 89 অনুসরণ করে।
ল্যান্থানাইডস - সিরিয়াম থেকে লুটেটিয়াম পর্যন্ত প্রথম সিরিজকে ল্যান্থানাইড বলা হয়। ল্যান্থানাইডগুলিকে বিরল পৃথিবীও বলা হয় কারণ এক সময় এগুলি দুর্লভ বলে মনে করা হত। এগুলি নরম ধাতু যা ছুরি দিয়ে কাটা যায়।
অ্যাক্টিনাইডস - সমস্ত অ্যাক্টিনাইডগুলি তেজস্ক্রিয়। থোরিয়াম, প্রোট্যাকটিনিয়াম এবং ইউরেনিয়াম একমাত্র অ্যাক্টিনাইড যা এখন পৃথিবীতে প্রাকৃতিকভাবে পাওয়া যায়। অন্যান্য সমস্ত অ্যাক্টিনাইডগুলি সিন্থেটিক উপাদান। সিন্থেটিক উপাদানগুলি পরীক্ষাগার এবং পারমাণবিক চুল্লিতে তৈরি করা হয়।
