Das Periodensystem der chemischen Elemente ist eine Liste bekannter Elemente. In der Tabelle sind die Elemente in der Reihenfolge ihrer Ordnungszahlen angeordnet, beginnend mit der niedrigsten Zahl. Die Ordnungszahl eines Elements ist die gleiche wie die Anzahl der Protonen in diesem bestimmten Atom.
Dmitri Mendelejew erhält die Anerkennung für die Gestaltung des modernen Periodensystems.
Jedes Element hat ein Quadrat im Periodensystem. In jedem Quadrat befinden sich 3 Informationen
- der Name des Elements
- sein offizielles chemisches Symbol
- seine Ordnungszahl
Das Quadrat für Eisen sieht beispielsweise so aus:
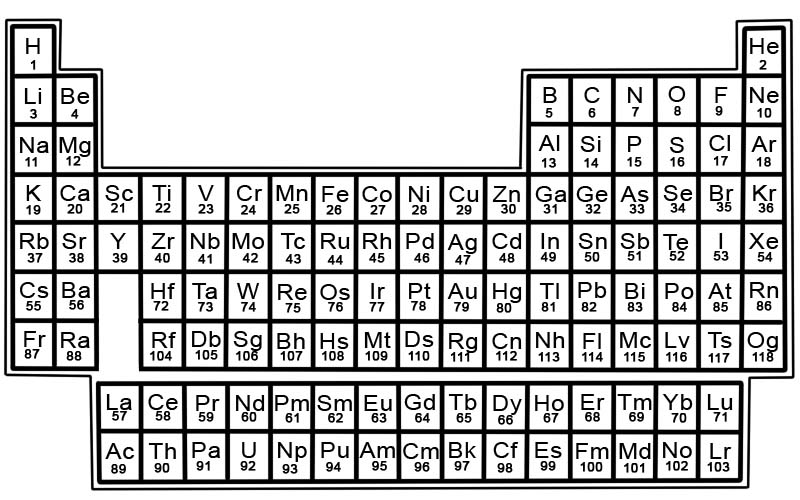
Elemente im Periodensystem sind in Zeilen und Spalten angeordnet.
- Zeilen werden Perioden genannt. Eine Periode ist eine Reihe von Elementen im Periodensystem, deren Eigenschaften sich allmählich und vorhersagbar ändern.
- Spalten werden als Gruppen bezeichnet. Das Periodensystem hat 18 Spalten mit Elementen. Jede Spalte enthält eine Gruppe oder Familie von Elementen. Eine Gruppe enthält Elemente, die ähnliche physikalische oder chemische Eigenschaften haben.
Zonen im Periodensystem
Das Periodensystem kann in Abschnitte unterteilt werden.
Ein Abschnitt besteht aus den ersten beiden Gruppen, Gruppe 1 und 2, und den Elementen in den Gruppen 3-18. Dies sind die repräsentativen Elemente. Sie umfassen Metalle, Halbmetalle und Nichtmetalle.
Metalle
Beispiele: Eisen, Zinn, Natrium und Plutonium.
- normalerweise fest bei Raumtemperatur (Quecksilber ist eine Ausnahme)
- Hochglanz (glänzend)
- metallisches Aussehen
- gute Wärme- und Stromleiter
- verformbar (kann gebogen und in dünne Bleche gehämmert werden)
- duktil (kann zu Draht gezogen werden)
- in Luft und Meerwasser korrodieren oder oxidieren
- normalerweise dicht (Ausnahmen sind Lithium, Kalium und Natrium)
- kann einen sehr hohen Schmelzpunkt haben
- verlieren leicht Elektronen
Metalloide
Beispiele: Bor, Silizium und Arsen.
- matt oder glänzend
- leiten normalerweise Wärme und Strom, wenn auch nicht so gut wie Metalle
- stellen oft gute Halbleiter her
- gibt es oft in mehreren Formen
- oft duktil
- oft formbar
- können bei Reaktionen Elektronen aufnehmen oder abgeben
Nichtmetalle
Beispiele: Sauerstoff, Chlor und Argon.
- stumpfes Aussehen
- normalerweise spröde
- schlechte Wärme- und Stromleiter
- normalerweise weniger dicht als Metalle
- normalerweise niedriger Schmelzpunkt von Feststoffen im Vergleich zu Metallen
- neigen dazu, bei chemischen Reaktionen Elektronen aufzunehmen
Gruppen 1 und 2
- Gruppe 1 - Alkalimetalle. Beispiele: Natrium, Lithium und Kalium.
- Gruppe 2 – Erdalkalimetalle Beispiele: Beryllium, Magnesium, Calcium, Barium und Radium. Jedes Erdalkalimetall ist dichter und härter und hat im gleichen Zeitraum einen höheren Schmelzpunkt als das Alkalimetall. Erdalkalimetalle sind reaktiv, aber nicht so reaktiv wie Alkalimetalle.
Gruppen 13 bis 18
Gruppe 13 – Familie Bor
- Beispiele: Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) und Thallium (Tl).
- Sie haben drei Valenzelektronen.
Gruppe 14 – Kohlenstofffamilie
- Beispiele: Kohlenstoff (C), Silizium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb).
- Sie alle haben vier Valenzelektronen.
Gruppe 15 – Stickstofffamilie
- Beispiele: Stickstoff (N), Phosphor (P), Arsen (As), Antimon (Sb) und Wismut (Bi).
- Diese Elemente haben alle fünf Valenzelektronen.
- Stickstoff und Phosphor sind Nichtmetalle.
Gruppe 16 – Sauerstofffamilie
- Beispiele: Sauerstoff (O), Schwefel (S), Selen (Se), Tellur (Te) und radioaktives Polonium (Po).
- Diese Gruppe hat sechs Valenzelektronen
- Diese werden auch als Chalkogene bezeichnet.
Gruppe 17 – Halogene
- Beispiele: Fluor (F), Chlor (Cl), Brom (Br), Jod (I) und Astat (At).
- Sie haben sieben Valenzelektronen.
- Diese Gruppe ist die erste, die vollständig aus Nichtmetallen besteht.
- Halogene sind hochreaktiv und können als solche in ausreichenden Mengen für biologische Organismen schädlich oder tödlich sein.
- Das Symbol X wird oft allgemein verwendet, um sich auf irgendein Halogen zu beziehen.
- Der Name „Halogen“ bedeutet „salzproduzierend“. Wenn Halogene mit Metallen reagieren, produzieren sie eine Vielzahl von Salzen, darunter Calcium, Fluorid, Natriumchlorid (Kochsalz), Silberbromid und Kaliumiodid.
Gruppe 18 – Edelgase
- Es gibt sechs Edelgase – Helium, Neon, Argon, Krypton, Xenon und Radon.
- Sie sind alle Gase und kommen in der Luft vor. Sie machen etwa 0,96 % der Atmosphäre aus.
- Alle von ihnen sind monoatomar, was bedeutet, dass jedes Molekül ein einzelnes Atom ist.
- Sie reagieren fast nie mit anderen Elementen. Dies liegt daran, dass sie eine volle 8-Elektronen-Außenhülle haben.
- Edelgase haben sehr niedrige Siede- und Schmelzpunkte, was sie als kryogene Kältemittel nützlich macht.
Übergangsmetalle
- Die Elemente in den Gruppen 3–12 sind Übergangselemente.
- Sie sind alle Metalle.
- Die meisten Übergangselemente kommen kombiniert mit anderen Elementen in Erzen vor.
- Einige wenige Übergangselemente wie Gold und Silber kommen als reine Elemente vor.
- Die Filamente von Glühbirnen bestehen aus Wolfram (Element 74), das den höchsten Schmelzpunkt aller Metalle hat und nicht schmilzt, wenn ein Strom hindurchfließt.
- Quecksilber, das den niedrigsten Schmelzpunkt aller Metalle hat, wird in Thermometern und Barometern verwendet.
- Quecksilber ist das einzige Metall, das bei Raumtemperatur flüssig ist.
Eiserner Dreiklang
Drei Elemente der Gruppe 4 – Eisen, Kobalt und Nickel – haben so ähnliche Eigenschaften, dass sie als Eisentriade bekannt sind.
Platingruppe
Ruthenium, Rhodium, Palladium, Osmium, Iridium und Platin werden manchmal als Platingruppe bezeichnet, weil sie ähnliche Eigenschaften haben. Sie lassen sich nicht leicht mit anderen Elementen kombinieren. Dadurch können sie als Katalysatoren verwendet werden.
Innere Übergangselemente
Einige Übergangselemente, sogenannte innere Übergangselemente, werden unterhalb der Haupttabelle platziert. Diese Elemente werden als Lanthaniden- und Aktinidenreihen bezeichnet, da eine Reihe auf das Element Lanthan, Element 57, und die andere Reihe auf Actinium, Element 89, folgt.
Lanthanide – Die erste Reihe, von Cer bis Lutetium, wird Lanthanide genannt. Die Lanthanoide werden auch als seltene Erden bezeichnet, weil man sie einst für knapp hielt. Sie sind weiche Metalle, die mit einem Messer geschnitten werden können.
Aktiniden – Alle Aktiniden sind radioaktiv. Thorium, Protactinium und Uran sind die einzigen Aktiniden, die heute natürlich auf der Erde vorkommen. Alle anderen Actiniden sind synthetische Elemente. Synthetische Elemente werden in Labors und Kernreaktoren hergestellt.
