La tabla periódica de los elementos químicos es una lista de elementos conocidos. En la tabla, los elementos se colocan en el orden de sus números atómicos comenzando por el número más bajo. El número atómico de un elemento es el mismo que el número de protones en ese átomo en particular.
Dmitri Mendeleev tiene el mérito de diseñar la tabla periódica moderna.
Cada elemento tiene un cuadrado en la tabla periódica. Hay 3 piezas de información en cada cuadrado
- el nombre del elemento
- su símbolo químico oficial
- su número atómico
Por ejemplo, el cuadrado de hierro se verá un poco así:
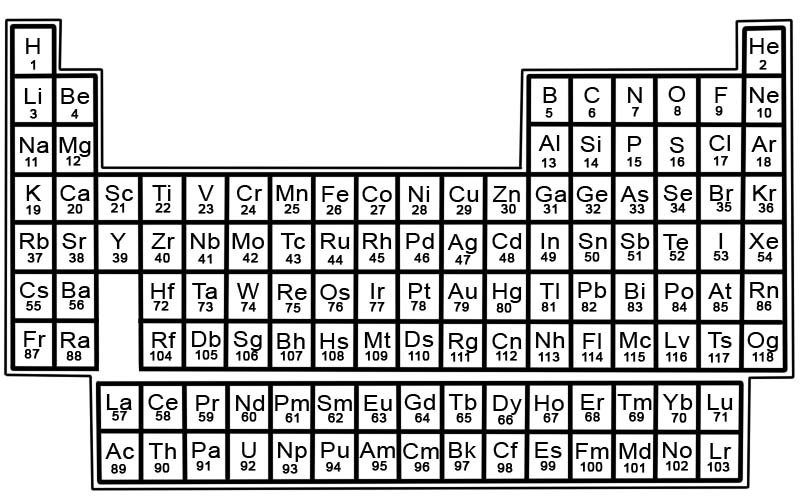
Los elementos de la tabla periódica están organizados en filas y columnas.
- Las filas se llaman períodos. Un período es una fila de elementos de la tabla periódica cuyas propiedades cambian de manera gradual y predecible.
- Las columnas se llaman grupos. La tabla periódica tiene 18 columnas de elementos. Cada columna contiene un grupo o familia de elementos. Un grupo contiene elementos que tienen propiedades físicas o químicas similares.
Zonas de la tabla periódica
La tabla periódica se puede dividir en secciones.
Una sección consta de los dos primeros grupos, Grupo 1 y 2, y los elementos de los Grupos 3-18. Estos son los elementos representativos. Incluyen metales, metaloides y no metales.
Rieles
Ejemplos: hierro, estaño, sodio y plutonio.
- generalmente sólido a temperatura ambiente (el mercurio es una excepción)
- alto brillo (brillante)
- apariencia metálica
- buenos conductores de calor y electricidad
- maleable (se puede doblar y machacar en láminas delgadas)
- dúctil (se puede estirar en alambre)
- corroer u oxidar en el aire y el agua de mar
- generalmente denso (las excepciones incluyen litio, potasio y sodio)
- puede tener un punto de fusión muy alto
- perder electrones fácilmente
Metaloides
Ejemplos: boro, silicio y arsénico.
- aburrido o brillante
- Por lo general, conducen calor y electricidad, aunque no tan bien como los metales.
- a menudo hacen buenos semiconductores
- a menudo existen en varias formas
- a menudo dúctil
- a menudo maleable
- puede ganar o perder electrones en reacciones
No metales
Ejemplos: oxígeno, cloro y argón.
- apariencia aburrida
- generalmente quebradizo
- malos conductores de calor y electricidad
- generalmente menos denso, en comparación con los metales
- generalmente bajo punto de fusión de los sólidos, en comparación con los metales
- tienden a ganar electrones en reacciones químicas
Grupos 1 y 2
- Grupo 1 - Metales alcalinos. Ejemplos: sodio, litio y potasio.
- Grupo 2 - Metales alcalinotérreos Ejemplos: berilio, magnesio, calcio, bario y radio. Cada metal alcalinotérreo es más denso y más duro y tiene un punto de fusión más alto que el metal alcalino en el mismo período. Los metales alcalinotérreos son reactivos pero no tan reactivos como los metales alcalinos.
Grupos 13 a 18
Grupo 13 - Familia Boro
- Ejemplos: boro (B), aluminio (Al), galio (Ga), indio (In) y talio (Tl).
- Tienen tres electrones de valencia.
Grupo 14 - Familia de carbono
- Ejemplos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn) y plomo (Pb).
- Todos tienen cuatro electrones de valencia.
Grupo 15 - Familia del nitrógeno
- Ejemplos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb) y bismuto (Bi).
- Todos estos elementos tienen cinco electrones de valencia.
- El nitrógeno y el fósforo no son metales.
Grupo 16 - Familia de oxígeno
- Ejemplos: oxígeno (O), azufre (S), selenio (Se), telurio (Te) y polonio radiactivo (Po).
- Este grupo tiene seis electrones de valencia.
- Estos también se conocen como calcógenos.
Grupo 17 - Halógenos
- Ejemplos: flúor (F), cloro (Cl), bromo (Br), yodo (I) y astato (At).
- Tienen siete electrones de valencia.
- Este grupo es el primero en estar compuesto íntegramente por no metales.
- Los halógenos son altamente reactivos y, como tales, pueden ser dañinos o letales para los organismos biológicos en cantidades suficientes.
- El símbolo X se utiliza a menudo de forma genérica para referirse a cualquier halógeno.
- El nombre "halógeno" significa "productor de sal". Cuando los halógenos reaccionan con los metales, producen una amplia gama de sales, que incluyen calcio, fluoruro, cloruro de sodio (sal de mesa), bromuro de plata y yoduro de potasio.
Grupo 18 - Gases nobles
- Hay seis gases nobles: helio, neón, argón, criptón, xenón y radón.
- Todos son gases y se encuentran en el aire. Constituyen alrededor del 0,96% de la atmósfera.
- Todos ellos son monoatómicos, lo que significa que cada molécula es un solo átomo.
- Casi nunca reaccionan con otros elementos. Esto se debe a que tienen una capa externa de electrones completa de 8 electrones.
- Los gases nobles tienen puntos de ebullición y fusión muy bajos, lo que los hace útiles como refrigerantes criogénicos.
Metales de transición
- Los elementos de los Grupos 3-12 son elementos de transición.
- Todos son metales.
- La mayoría de los elementos de transición se encuentran combinados con otros elementos en los minerales.
- Algunos elementos de transición, como el oro y la plata, se encuentran como elementos puros.
- Los filamentos de las bombillas están hechos de tungsteno (elemento 74) que tiene el punto de fusión más alto de cualquier metal y no se derretirá cuando una corriente lo atraviese.
- El mercurio, que tiene el punto de fusión más bajo de todos los metales, se usa en termómetros y barómetros.
- El mercurio es el único metal líquido a temperatura ambiente.
Tríada de hierro
Tres elementos del grupo 4 (hierro, cobalto y níquel) tienen propiedades tan similares que se conocen como la tríada del hierro.
Grupo platino
El rutenio, el rodio, el paladio, el osmio, el iridio y el platino a veces se denominan grupo del platino porque tienen propiedades similares. No se combinan fácilmente con otros elementos. Como resultado, pueden usarse como catalizadores.
Elementos de transición interior
Algunos elementos de transición, llamados elementos de transición internos, se colocan debajo de la mesa principal. Estos elementos se denominan series de lantánidos y actínidos porque una serie sigue al elemento lantano, elemento 57, y la otra serie sigue al actinio, elemento 89.
Lantánidos : la primera serie, desde el cerio hasta el lutecio, se llama lantánidos. Los lantánidos también se denominan tierras raras porque en un momento se pensó que eran escasos. Son metales blandos que se pueden cortar con un cuchillo.
Actínidos : todos los actínidos son radiactivos. El torio, el protactinio y el uranio son los únicos actínidos que ahora se encuentran naturalmente en la Tierra. Todos los demás actínidos son elementos sintéticos. Los elementos sintéticos se fabrican en laboratorios y reactores nucleares.
