جدول تناوبی عناصر شیمیایی فهرستی از عناصر شناخته شده است. در جدول، عناصر به ترتیب اعداد اتمی خود با کمترین عدد شروع می شوند. عدد اتمی یک عنصر برابر با تعداد پروتون های آن اتم خاص است.
دیمیتری مندلیف برای طراحی جدول تناوبی مدرن اعتبار کسب می کند.
هر عنصر در جدول تناوبی یک مربع دارد. در هر مربع 3 قطعه اطلاعات وجود دارد
- نام عنصر
- نماد شیمیایی رسمی آن
- عدد اتمی آن
به عنوان مثال، مربع برای آهن کمی شبیه به این خواهد بود:
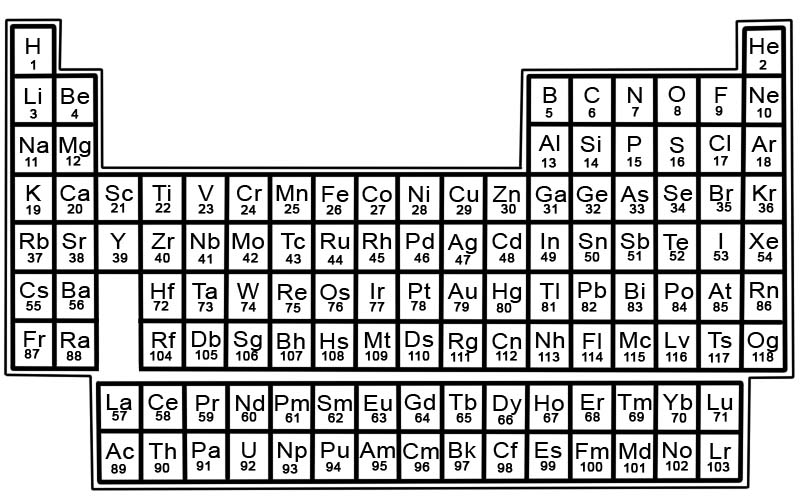
عناصر جدول تناوبی در ردیف و ستون مرتب شده اند.
- سطرها را دوره می گویند. نقطه، ردیفی از عناصر در جدول تناوبی است که ویژگی های آن به تدریج و به طور قابل پیش بینی تغییر می کند.
- به ستون ها گروه گفته می شود. جدول تناوبی دارای 18 ستون از عناصر است. هر ستون شامل یک گروه یا خانواده از عناصر است. یک گروه شامل عناصری است که خواص فیزیکی یا شیمیایی مشابهی دارند.
مناطق در جدول تناوبی
جدول تناوبی را می توان به بخش هایی تقسیم کرد.
یک بخش شامل دو گروه اول، گروه 1 و 2 و عناصر گروه 3-18 است. اینها عناصر نماینده هستند. آنها شامل فلزات، متالوئیدها و نافلزات هستند.
فلزات
به عنوان مثال: آهن، قلع، سدیم و پلوتونیوم.
- معمولا در دمای اتاق جامد است (جیوه یک استثنا است)
- درخشندگی بالا (براق)
- ظاهر فلزی
- رسانای خوب گرما و الکتریسیته
- چکش خوار (می توان آن را خم کرد و به صورت ورقه های نازک کوبید)
- شکل پذیر (قابلیت کشیدن به سیم)
- در هوا و آب دریا خورده یا اکسید می شود
- معمولاً متراکم (استثناها شامل لیتیوم، پتاسیم و سدیم هستند)
- ممکن است نقطه ذوب بسیار بالایی داشته باشد
- به راحتی الکترون ها را از دست می دهند
متالوئیدها
به عنوان مثال: بور، سیلیکون و آرسنیک.
- مات یا براق
- معمولا گرما و الکتریسیته را هدایت می کنند، البته نه به خوبی فلزات
- اغلب نیمه هادی های خوبی می سازند
- اغلب به چندین شکل وجود دارد
- اغلب انعطاف پذیر
- اغلب چکش خوار
- ممکن است در واکنش ها الکترون به دست آورد یا از دست بدهد
غیر فلزات
به عنوان مثال: اکسیژن، کلر و آرگون.
- ظاهر کسل کننده
- معمولا شکننده
- هادی های ضعیف گرما و الکتریسیته
- معمولاً در مقایسه با فلزات چگالی کمتری دارد
- معمولاً نقطه ذوب پایین جامدات در مقایسه با فلزات
- تمایل به کسب الکترون در واکنش های شیمیایی دارند
گروه 1 و 2
- گروه 1 - فلزات قلیایی. به عنوان مثال: سدیم، لیتیوم و پتاسیم.
- گروه 2 - فلزات قلیایی خاکی مثالها: بریلیم، منیزیم، کلسیم، باریم و رادیوم. هر فلز خاکی قلیایی متراکم تر و سخت تر است و نقطه ذوب بالاتری نسبت به فلز قلیایی در همان دوره دارد. فلزات قلیایی خاکی واکنش پذیر هستند اما به اندازه فلزات قلیایی واکنش پذیر نیستند.
گروه 13 تا 18
گروه 13 - خانواده بور
- به عنوان مثال: بور (B)، آلومینیوم (Al)، گالیم (Ga)، ایندیم (In) و تالیم (Tl).
- آنها سه الکترون ظرفیت دارند.
گروه 14 - خانواده کربن
- به عنوان مثال: کربن (C)، سیلیکون (Si)، ژرمانیوم (Ge)، قلع (Sn) و سرب (Pb).
- همه آنها چهار الکترون ظرفیت دارند.
گروه 15 - خانواده نیتروژن
- به عنوان مثال: نیتروژن (N)، فسفر (P)، آرسنیک (As)، آنتیموان (Sb)، و بیسموت (Bi).
- این عناصر همگی دارای پنج الکترون ظرفیت هستند.
- نیتروژن و فسفر غیر فلزات هستند.
گروه 16 - خانواده اکسیژن
- به عنوان مثال: اکسیژن (O)، گوگرد (S)، سلنیوم (Se)، تلوریم (Te)، و پلونیوم رادیواکتیو (Po).
- این گروه دارای شش الکترون ظرفیت است
- اینها به نام کالکوژن نیز شناخته می شوند.
گروه 17 - هالوژن ها
- به عنوان مثال: فلوئور (F)، کلر (Cl)، برم (Br)، ید (I) و استاتین (At).
- آنها هفت الکترون ظرفیت دارند.
- این گروه اولین گروهی است که کاملاً از فلزات غیرفلزی تشکیل شده است.
- هالوژن ها بسیار واکنش پذیر هستند و به همین دلیل می توانند در مقادیر کافی برای موجودات بیولوژیکی مضر یا کشنده باشند.
- نماد X اغلب به طور کلی برای اشاره به هر هالوژن استفاده می شود.
- نام "هالوژن" به معنای "نمک ساز" است. هنگامی که هالوژن ها با فلزات واکنش می دهند، طیف وسیعی از نمک ها از جمله کلسیم، فلوراید، کلرید سدیم (نمک خوراکی)، برمید نقره و یدید پتاسیم را تولید می کنند.
گروه 18 - گازهای نجیب
- شش گاز نجیب وجود دارد - هلیوم، نئون، آرگون، کریپتون، زنون و رادون.
- همه آنها گاز هستند و در هوا یافت می شوند. آنها حدود 0.96 درصد جو را تشکیل می دهند.
- همه آنها تک اتمی هستند، یعنی هر مولکول یک اتم واحد است.
- آنها تقریباً هرگز با عناصر دیگر واکنش نشان نمی دهند. این به این دلیل است که آنها دارای یک پوسته الکترونی بیرونی کامل 8 الکترونی هستند.
- گازهای نجیب نقطه جوش و ذوب بسیار پایینی دارند که آنها را به عنوان مبردهای برودتی مفید می کند.
فلزات واسطه
- عناصر گروه 3-12 عناصر انتقالی هستند.
- همه آنها فلز هستند.
- اکثر عناصر انتقالی در ترکیب با عناصر دیگر در سنگ معدن یافت می شوند.
- چند عنصر انتقالی مانند طلا و نقره به عنوان عناصر خالص یافت می شوند.
- رشته های لامپ ها از تنگستن (عنصر 74) ساخته شده اند که بالاترین نقطه ذوب را در بین فلزات دارد و با عبور جریان از آن ذوب نمی شود.
- جیوه که کمترین نقطه ذوب را در بین فلزات دارد، در دماسنج ها و فشارسنج ها استفاده می شود.
- جیوه تنها فلزی است که در دمای اتاق مایع است.
سه گانه آهن
سه عنصر در گروه 4 - آهن، کبالت و نیکل - دارای خواص مشابهی هستند که به عنوان سه گانه آهن شناخته می شوند.
گروه پلاتین
روتنیوم، رودیوم، پالادیوم، اسمیم، ایریدیوم و پلاتین را گاهی اوقات گروه پلاتین می نامند زیرا دارای خواص مشابهی هستند. آنها به راحتی با عناصر دیگر ترکیب نمی شوند. در نتیجه می توان از آنها به عنوان کاتالیزور استفاده کرد.
عناصر انتقال درونی
برخی از عناصر انتقال، که عناصر انتقال داخلی نامیده می شوند، در زیر جدول اصلی قرار می گیرند. این عناصر سری لانتانید و اکتینید نامیده می شوند زیرا یک سری پس از عنصر لانتانیم، عنصر 57، و سری دیگر پس از اکتینیم، عنصر 89 قرار می گیرند.
لانتانیدها - سری اول، از سریم تا لوتتیوم، لانتانیدها نامیده می شوند. لانتانیدها نیز زمین کمیاب نامیده می شوند زیرا زمانی تصور می شد که کمیاب باشند. آنها فلزات نرمی هستند که می توان آنها را با چاقو برش داد.
اکتینیدها - همه اکتینیدها رادیواکتیو هستند. توریم، پروتاکتینیم و اورانیوم تنها اکتینیدهایی هستند که اکنون به طور طبیعی در زمین یافت می شوند. تمام اکتینیدهای دیگر عناصر مصنوعی هستند. عناصر مصنوعی در آزمایشگاه ها و راکتورهای هسته ای ساخته می شوند.
