Le tableau périodique des éléments chimiques est une liste d'éléments connus. Dans le tableau, les éléments sont placés dans l'ordre de leurs numéros atomiques en commençant par le numéro le plus bas. Le numéro atomique d'un élément est le même que le nombre de protons dans cet atome particulier.
Dmitri Mendeleev obtient le crédit pour la conception du tableau périodique moderne.
Chaque élément a un carré dans le tableau périodique. Il y a 3 informations dans chaque case
- le nom de l'élément
- son symbole chimique officiel
- son numéro atomique
Par exemple, le carré du fer ressemblera un peu à ceci :
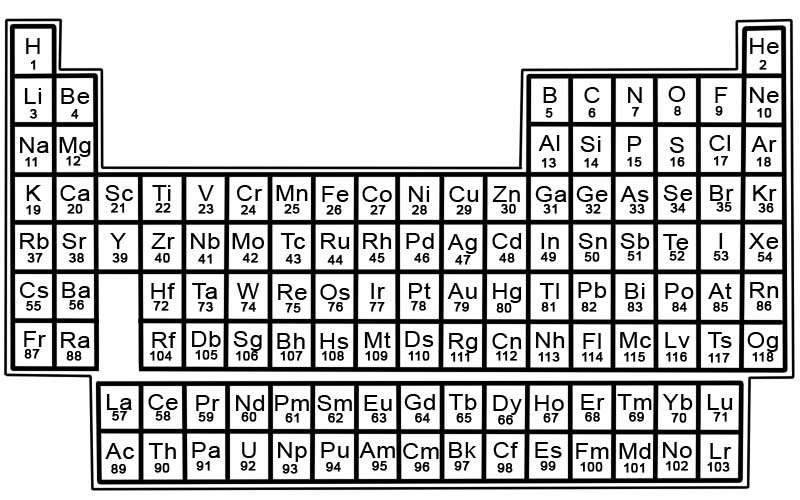
Les éléments du tableau périodique sont disposés en lignes et en colonnes.
- Les lignes sont appelées périodes. Une période est une rangée d'éléments du tableau périodique dont les propriétés changent progressivement et de manière prévisible.
- Les colonnes sont appelées groupes. Le tableau périodique comporte 18 colonnes d'éléments. Chaque colonne contient un groupe ou une famille d'éléments. Un groupe contient des éléments qui ont des propriétés physiques ou chimiques similaires.
Zones du tableau périodique
Le tableau périodique peut être divisé en sections.
Une section comprend les deux premiers groupes, les groupes 1 et 2, et les éléments des groupes 3-18. Ce sont les éléments représentatifs. Ils comprennent les métaux, les métalloïdes et les non-métaux.
Métaux
Exemples : fer, étain, sodium et plutonium.
- généralement solide à température ambiante (le mercure est une exception)
- haute brillance (brillant)
- aspect métallique
- bons conducteurs de chaleur et d'électricité
- malléable (peut être plié et martelé en feuilles minces)
- ductile (peut être étiré en fil)
- se corroder ou s'oxyder dans l'air et l'eau de mer
- généralement dense (les exceptions incluent le lithium, le potassium et le sodium)
- peut avoir un point de fusion très élevé
- perdre facilement des électrons
Métalloïdes
Exemples : bore, silicium et arsenic.
- terne ou brillant
- conduisent généralement la chaleur et l'électricité, mais pas aussi bien que les métaux
- font souvent de bons semi-conducteurs
- existent souvent sous plusieurs formes
- souvent ductile
- souvent malléable
- peut gagner ou perdre des électrons dans les réactions
Non-métaux
Exemples : oxygène, chlore et argon.
- aspect terne
- généralement cassant
- mauvais conducteurs de chaleur et d'électricité
- généralement moins dense que les métaux
- point de fusion généralement bas des solides, par rapport aux métaux
- ont tendance à gagner des électrons dans les réactions chimiques
Groupes 1 et 2
- Groupe 1 - Métaux alcalins. Exemples : sodium, lithium et potassium.
- Groupe 2 - Métaux alcalino-terreux Exemples : béryllium, magnésium, calcium, baryum et radium. Chaque métal alcalino-terreux est plus dense et plus dur et a un point de fusion plus élevé que le métal alcalin au cours de la même période. Les métaux alcalino-terreux sont réactifs mais pas aussi réactifs que les métaux alcalins.
Groupes 13 à 18
Groupe 13 – Famille du bore
- Exemples : bore (B), aluminium (Al), gallium (Ga), indium (In) et thallium (Tl).
- Ils ont trois électrons de valence.
Groupe 14 – Famille carbone
- Exemples : carbone (C), silicium (Si), germanium (Ge), étain (Sn) et plomb (Pb).
- Ils ont tous quatre électrons de valence.
Groupe 15 – Famille de l'azote
- Exemples : azote (N), phosphore (P), arsenic (As), antimoine (Sb) et bismuth (Bi).
- Ces éléments ont tous cinq électrons de valence.
- L'azote et le phosphore sont des non-métaux.
Groupe 16 – Famille Oxygène
- Exemples : oxygène (O), soufre (S), sélénium (Se), tellure (Te) et polonium radioactif (Po).
- Ce groupe a six électrons de valence
- Ceux-ci sont également connus sous le nom de chalcogènes.
Groupe 17 – Halogènes
- Exemples : fluor (F), chlore (Cl), brome (Br), iode (I) et astatine (At).
- Ils ont sept électrons de valence.
- Ce groupe est le premier à être entièrement composé de non-métaux.
- Les halogènes sont hautement réactifs et, en tant que tels, peuvent être nocifs ou mortels pour les organismes biologiques en quantités suffisantes.
- Le symbole X est souvent utilisé de manière générique pour désigner n'importe quel halogène.
- Le nom « halogène » signifie « producteur de sel ». Lorsque les halogènes réagissent avec les métaux, ils produisent une large gamme de sels, notamment le calcium, le fluorure, le chlorure de sodium (sel de table), le bromure d'argent et l'iodure de potassium.
Groupe 18 – Gaz nobles
- Il existe six gaz rares : l'hélium, le néon, l'argon, le krypton, le xénon et le radon.
- Ce sont tous des gaz et on les trouve dans l'air. Ils représentent environ 0,96% de l'atmosphère.
- Tous sont monoatomiques, ce qui signifie que chaque molécule est un seul atome.
- Ils ne réagissent presque jamais avec d'autres éléments. C'est parce qu'ils ont une couche d'électrons externe complète de 8 électrons.
- Les gaz nobles ont des points d'ébullition et de fusion très bas, ce qui les rend utiles comme réfrigérants cryogéniques.
Métaux de transition
- Les éléments des groupes 3 à 12 sont des éléments de transition.
- Ce sont tous des métaux.
- La plupart des éléments de transition se trouvent combinés avec d'autres éléments dans les minerais.
- Quelques éléments de transition tels que l'or et l'argent se trouvent sous forme d'éléments purs.
- Les filaments des ampoules sont faits de tungstène (élément 74) qui a le point de fusion le plus élevé de tous les métaux et ne fondra pas lorsqu'un courant le traverse.
- Le mercure, qui a le point de fusion le plus bas de tous les métaux, est utilisé dans les thermomètres et les baromètres.
- Le mercure est le seul métal liquide à température ambiante.
Triade de fer
Trois éléments du groupe 4 - le fer, le cobalt et le nickel - ont des propriétés si similaires qu'ils sont connus sous le nom de triade du fer.
Groupe Platine
Le ruthénium, le rhodium, le palladium, l'osmium, l'iridium et le platine sont parfois appelés le groupe du platine car ils ont des propriétés similaires. Ils ne se combinent pas facilement avec d'autres éléments. En conséquence, ils peuvent être utilisés comme catalyseurs.
Éléments de transition intérieurs
Certains éléments de transition, appelés éléments de transition internes, sont placés sous le tableau principal. Ces éléments sont appelés les séries des lanthanides et des actinides car une série suit l'élément lanthane, élément 57, et l'autre série suit l'actinium, élément 89.
Lanthanides - La première série, du cérium au lutétium, s'appelle les lanthanides. Les lanthanides sont aussi appelées les terres rares parce qu'à une époque on les croyait rares. Ce sont des métaux mous qui peuvent être coupés avec un couteau.
Actinides – Tous les actinides sont radioactifs. Le thorium, le protactinium et l'uranium sont les seuls actinides que l'on trouve désormais naturellement sur Terre. Tous les autres actinides sont des éléments synthétiques. Les éléments synthétiques sont fabriqués dans les laboratoires et les réacteurs nucléaires.
