रासायनिक तत्वों की आवर्त सारणी ज्ञात तत्वों की एक सूची है। तालिका में, तत्वों को उनके परमाणु क्रमांक के क्रम में रखा गया है, जो सबसे छोटी संख्या से शुरू होता है। किसी तत्व का परमाणु क्रमांक उस विशेष परमाणु में प्रोटॉनों की संख्या के बराबर होता है।
आधुनिक आवर्त सारणी को डिजाइन करने का श्रेय दिमित्री मेंडलीफ को जाता है।
आवर्त सारणी में प्रत्येक तत्व का एक वर्ग होता है। प्रत्येक वर्ग में जानकारी के 3 टुकड़े हैं
- तत्व का नाम
- इसका आधिकारिक रासायनिक प्रतीक
- इसका परमाणु क्रमांक
उदाहरण के लिए, लोहे का वर्ग कुछ इस तरह दिखेगा:
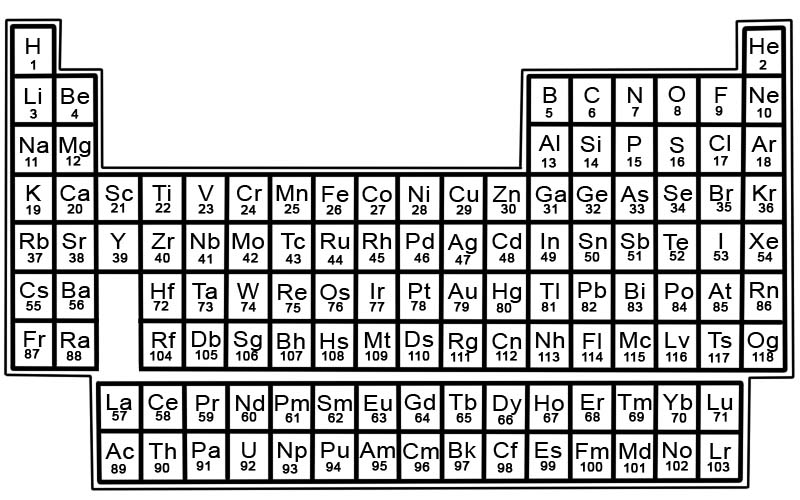
आवर्त सारणी में तत्वों को पंक्तियों और स्तंभों में व्यवस्थित किया जाता है।
- पंक्तियों को काल कहा जाता है। एक आवर्त आवर्त सारणी में तत्वों की एक पंक्ति है जिसके गुण धीरे-धीरे और अनुमानित रूप से बदलते हैं।
- कॉलम को समूह कहा जाता है। आवर्त सारणी में तत्वों के 18 स्तंभ हैं। प्रत्येक कॉलम में तत्वों का एक समूह या परिवार होता है। एक समूह में ऐसे तत्व होते हैं जिनमें समान भौतिक या रासायनिक गुण होते हैं।
आवर्त सारणी पर क्षेत्र
आवर्त सारणी को वर्गों में विभाजित किया जा सकता है।
एक खंड में पहले दो समूह, समूह 1 और 2, और समूह 3-18 के तत्व शामिल हैं। ये प्रतिनिधि तत्व हैं। इनमें धातु, उपधातु और अधातु शामिल हैं।
धातुओं
उदाहरण: लोहा, टिन, सोडियम और प्लूटोनियम।
- आमतौर पर कमरे के तापमान पर ठोस (पारा एक अपवाद है)
- उच्च चमक (चमकदार)
- धातु उपस्थिति
- गर्मी और बिजली के अच्छे संवाहक
- निंदनीय (घुमाया जा सकता है और पतली चादरों में बढ़ाया जा सकता है)
- नमनीय (तार में खींचा जा सकता है)
- हवा और समुद्री जल में जंग या ऑक्सीकरण करना
- आमतौर पर घने (अपवादों में लिथियम, पोटेशियम और सोडियम शामिल हैं)
- बहुत अधिक गलनांक हो सकता है
- आसानी से इलेक्ट्रॉनों को खो देते हैं
Metalloids
उदाहरण: बोरॉन, सिलिकॉन और आर्सेनिक।
- सुस्त या चमकदार
- आमतौर पर गर्मी और बिजली का संचालन करते हैं, हालांकि धातुओं के साथ-साथ नहीं
- अक्सर अच्छे अर्धचालक बनाते हैं
- अक्सर कई रूपों में मौजूद होते हैं
- अक्सर नमनीय
- अक्सर निंदनीय
- प्रतिक्रियाओं में इलेक्ट्रॉनों को प्राप्त या खो सकता है
nonmetals
उदाहरण: ऑक्सीजन, क्लोरीन और आर्गन।
- सुस्त उपस्थिति
- आमतौर पर भंगुर
- गर्मी और बिजली के कुचालक
- धातुओं की तुलना में आमतौर पर कम घना होता है
- धातुओं की तुलना में आमतौर पर ठोस पदार्थों का कम गलनांक होता है
- रासायनिक अभिक्रियाओं में इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति होती है
समूह 1 और 2
- समूह 1 - क्षार धातु। उदाहरण: सोडियम, लिथियम और पोटेशियम।
- समूह 2 - क्षारीय पृथ्वी धातुएं उदाहरण: बेरिलियम, मैग्नीशियम, कैल्शियम, बेरियम और रेडियम। प्रत्येक क्षारीय पृथ्वी धातु सघन और कठोर होती है और इसी अवधि में क्षार धातु की तुलना में उच्च गलनांक होता है। क्षारीय मृदा धातुएँ प्रतिक्रियाशील होती हैं लेकिन क्षार धातुओं की तरह प्रतिक्रियाशील नहीं होती हैं।
समूह 13 से 18
समूह 13 - बोरॉन परिवार
- उदाहरण: बोरॉन (बी), एल्यूमीनियम (अल), गैलियम (गा), इंडियम (इन), और थैलियम (टीएल)।
- उनके पास तीन वैलेंस इलेक्ट्रॉन हैं।
समूह 14 - कार्बन परिवार
- उदाहरण: कार्बन (C), सिलिकॉन (Si), जर्मेनियम (Ge), टिन (Sn), और लेड (Pb)।
- उन सभी में चार वैलेंस इलेक्ट्रॉन होते हैं।
समूह 15 - नाइट्रोजन परिवार
- उदाहरण: नाइट्रोजन (N), फास्फोरस (P), आर्सेनिक (As), सुरमा (Sb), और बिस्मथ (Bi)।
- इन सभी तत्वों में पांच वैलेंस इलेक्ट्रॉन होते हैं।
- नाइट्रोजन और फास्फोरस अधातु हैं।
समूह 16 - ऑक्सीजन परिवार
- उदाहरण: ऑक्सीजन (O), सल्फर (S), सेलेनियम (Se), टेल्यूरियम (Te), और रेडियोधर्मी पोलोनियम (Po)।
- इस समूह में छह संयोजकता इलेक्ट्रॉन हैं
- इन्हें चाकोजेन्स के रूप में भी जाना जाता है।
समूह 17 - हलोजन्स
- उदाहरण: फ्लोरीन (F), क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I), और एस्टैटिन (At)।
- उनके पास सात वैलेंस इलेक्ट्रॉन हैं।
- यह समूह पूरी तरह से अधातुओं से युक्त पहला समूह है।
- हैलोजन अत्यधिक प्रतिक्रियाशील होते हैं, और इसलिए पर्याप्त मात्रा में जैविक जीवों के लिए हानिकारक या घातक हो सकते हैं।
- किसी भी हलोजन को संदर्भित करने के लिए प्रतीक एक्स अक्सर सामान्य रूप से उपयोग किया जाता है।
- "हलोजन" नाम का अर्थ है "नमक उत्पादक"। जब हैलोजन धातुओं के साथ प्रतिक्रिया करते हैं तो वे कैल्शियम, फ्लोराइड, सोडियम क्लोराइड (टेबल सॉल्ट), सिल्वर ब्रोमाइड और पोटेशियम आयोडाइड सहित लवणों की एक विस्तृत श्रृंखला का उत्पादन करते हैं।
समूह 18 - महान गैसें
- छह महान गैसें हैं - हीलियम, नियॉन, आर्गन, क्रिप्टन, क्सीनन और रेडॉन।
- ये सभी गैसें हैं और हवा में पाई जाती हैं। वे वायुमंडल का लगभग 0.96% भाग बनाते हैं।
- वे सभी एकपरमाणुक हैं, जिसका अर्थ है कि प्रत्येक अणु एक एकल परमाणु है।
- वे लगभग कभी भी अन्य तत्वों के साथ प्रतिक्रिया नहीं करते हैं। ऐसा इसलिए है क्योंकि उनके पास पूर्ण 8 इलेक्ट्रॉन बाहरी इलेक्ट्रॉन शेल हैं।
- महान गैसों में बहुत कम क्वथनांक और गलनांक होते हैं, जो उन्हें क्रायोजेनिक रेफ्रिजरेंट के रूप में उपयोगी बनाते हैं।
संक्रमण धातुओं
- समूह 3-12 के तत्व संक्रमण तत्व हैं।
- वे सभी धातु हैं।
- अधिकांश संक्रमण तत्व अयस्कों में अन्य तत्वों के साथ संयुक्त पाए जाते हैं।
- कुछ संक्रमण तत्व जैसे सोना और चांदी शुद्ध तत्व के रूप में पाए जाते हैं।
- प्रकाश बल्बों के तंतु टंगस्टन (तत्व 74) से बने होते हैं, जिसमें किसी भी धातु का गलनांक सबसे अधिक होता है और जब कोई धारा इससे गुजरती है तो पिघलती नहीं है।
- पारा, जिसका किसी भी धातु का गलनांक सबसे कम होता है, का उपयोग थर्मामीटर और बैरोमीटर में किया जाता है।
- पारा एकमात्र धातु है जो कमरे के तापमान पर तरल है।
आयरन ट्रायड
समूह 4 के तीन तत्वों - लोहा, कोबाल्ट और निकल - में ऐसे समान गुण होते हैं कि उन्हें लौह त्रय के रूप में जाना जाता है।
प्लेटिनम समूह
रूथेनियम, रोडियम, पैलेडियम, ऑस्मियम, इरिडियम और प्लैटिनम को कभी-कभी प्लैटिनम समूह कहा जाता है क्योंकि उनके समान गुण होते हैं। वे अन्य तत्वों के साथ आसानी से संयोजित नहीं होते हैं। नतीजतन, उन्हें उत्प्रेरक के रूप में इस्तेमाल किया जा सकता है।
आंतरिक संक्रमण तत्व
कुछ संक्रमण तत्व, जिन्हें आंतरिक संक्रमण तत्व कहा जाता है, को मुख्य तालिका के नीचे रखा गया है। इन तत्वों को लैंथेनाइड और एक्टिनाइड श्रृंखला कहा जाता है क्योंकि एक श्रृंखला लैंथेनम तत्व का अनुसरण करती है, तत्व 57, और दूसरी श्रृंखला एक्टिनियम, तत्व 89 का अनुसरण करती है।
लैंथेनाइड्स - सेरियम से ल्यूटेटियम तक की पहली श्रृंखला को लैंथेनाइड्स कहा जाता है। लैंथेनाइड्स को दुर्लभ पृथ्वी भी कहा जाता है क्योंकि एक समय में उन्हें दुर्लभ माना जाता था। वे नरम धातुएं हैं जिन्हें चाकू से काटा जा सकता है।
एक्टिनाइड्स - सभी एक्टिनाइड्स रेडियोधर्मी हैं। थोरियम, प्रोटैक्टीनियम और यूरेनियम ही एकमात्र एक्टिनाइड्स हैं जो अब पृथ्वी पर प्राकृतिक रूप से पाए जाते हैं। अन्य सभी एक्टिनाइड्स सिंथेटिक तत्व हैं। सिंथेटिक तत्व प्रयोगशालाओं और परमाणु रिएक्टरों में बनाए जाते हैं।
