Periodni sustav kemijskih elemenata je popis poznatih elemenata. U tablici su elementi raspoređeni redoslijedom njihovih atomskih brojeva počevši s najmanjim brojem. Atomski broj elementa jednak je broju protona u tom atomu.
Dmitrij Mendeljejev je zaslužan za dizajn modernog periodnog sustava.
Svaki element ima kvadrat u periodnom sustavu. U svakom kvadratu nalaze se 3 informacije
- naziv elementa
- njegov službeni kemijski simbol
- njegov atomski broj
Na primjer, kvadrat za željezo izgledat će otprilike ovako:
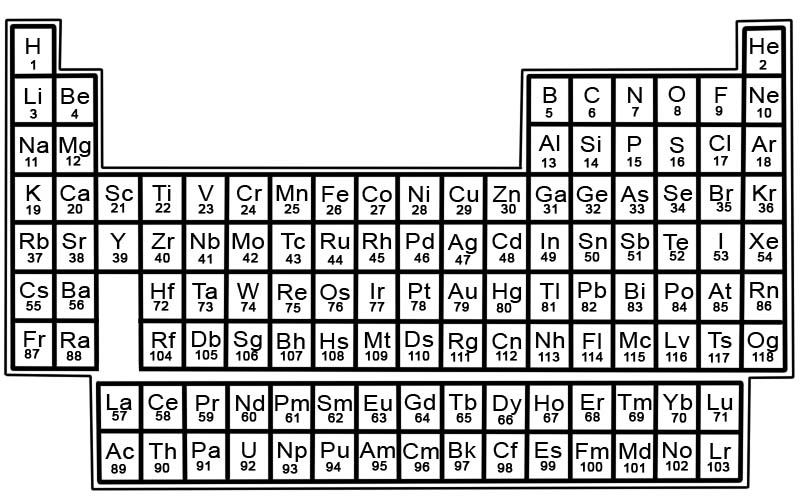
Elementi u periodnom sustavu raspoređeni su u redove i stupce.
- Redovi se nazivaju periodima. Točka je niz elemenata u periodnom sustavu čija se svojstva mijenjaju postupno i predvidljivo.
- Kolone se nazivaju grupe. Periodni sustav ima 18 stupaca elemenata. Svaki stupac sadrži grupu ili obitelj elemenata. Skupina sadrži elemente koji imaju slična fizikalna ili kemijska svojstva.
Zone na periodnom sustavu
Periodični sustav se može podijeliti u odjeljke.
Jedan odjeljak se sastoji od prve dvije skupine, skupine 1 i 2, te elemenata u skupinama 3-18. To su reprezentativni elementi. Oni uključuju metale, metaloide i nemetale.
Metali
Primjeri: željezo, kositar, natrij i plutonij.
- obično krut na sobnoj temperaturi (živa je iznimka)
- visoki sjaj (sjajni)
- metalni izgled
- dobri provodnici topline i struje
- savitljiv (može se saviti i izlupati u tanke listove)
- duktilna (može se uvući u žicu)
- korodiraju ili oksidiraju u zraku i morskoj vodi
- obično gusta (iznimke uključuju litij, kalij i natrij)
- može imati vrlo visoku točku taljenja
- lako gube elektrone
Metaloidi
Primjeri: bor, silicij i arsen.
- dosadan ili sjajan
- obično provode toplinu i električnu energiju, iako ne tako dobro kao metali
- često prave dobre poluvodiče
- često postoje u nekoliko oblika
- često duktilni
- često savitljiv
- mogu dobiti ili izgubiti elektrone u reakcijama
Nemetali
Primjeri: kisik, klor i argon.
- dosadan izgled
- obično krhka
- loši provodnici topline i struje
- obično manje gusto, u usporedbi s metalima
- obično nisko talište krutih tvari, u usporedbi s metalima
- imaju tendenciju dobivanja elektrona u kemijskim reakcijama
Grupe 1 i 2
- Grupa 1 - Alkalijski metali. Primjeri: natrij, litij i kalij.
- Grupa 2 - Zemnoalkalijski metali Primjeri: berilij, magnezij, kalcij, barij i radij. Svaki zemnoalkalijski metal je gušći i tvrđi i ima višu točku taljenja od alkalijskog metala u istom razdoblju. Zemnoalkalijski metali su reaktivni, ali ne tako reaktivni kao alkalni metali.
Grupe od 13 do 18
Grupa 13 – Obitelj bora
- Primjeri: bor (B), aluminij (Al), galij (Ga), indij (In) i talij (Tl).
- Imaju tri valentna elektrona.
Grupa 14 – Obitelj ugljika
- Primjeri: ugljik (C), silicij (Si), germanij (Ge), kositar (Sn) i olovo (Pb).
- Svi imaju četiri valentna elektrona.
Grupa 15 – Obitelj dušika
- Primjeri: dušik (N), fosfor (P), arsen (As), antimon (Sb) i bizmut (Bi).
- Svi ovi elementi imaju pet valentnih elektrona.
- Dušik i fosfor su nemetali.
Grupa 16 – Obitelj kisika
- Primjeri: kisik (O), sumpor (S), selen (Se), telurij (Te) i radioaktivni polonij (Po).
- Ova skupina ima šest valentnih elektrona
- Oni su također poznati kao halkogeni.
Skupina 17 – Halogeni
- Primjeri: fluor (F), klor (Cl), brom (Br), jod (I) i astat (At).
- Imaju sedam valentnih elektrona.
- Ova je skupina prva koja se sastoji od potpuno nemetala.
- Halogeni su vrlo reaktivni i kao takvi mogu biti štetni ili smrtonosni za biološke organizme u dovoljnim količinama.
- Simbol X se često koristi općenito za označavanje bilo kojeg halogena.
- Naziv "halogen" znači "koji proizvodi sol". Kada halogeni reagiraju s metalima, oni proizvode širok raspon soli, uključujući kalcij, fluorid, natrijev klorid (kuhinjska sol), srebrni bromid i kalijev jodid.
Grupa 18 – Plemeniti plinovi
- Postoji šest plemenitih plinova - helij, neon, argon, kripton, ksenon i radon.
- Svi su plinovi i nalaze se u zraku. Oni čine oko 0,96% atmosfere.
- Svi su jednoatomni, što znači da je svaka molekula jedan atom.
- Gotovo nikad ne reagiraju s drugim elementima. To je zato što imaju punu vanjsku elektronsku ljusku od 8 elektrona.
- Plemeniti plinovi imaju vrlo nisko vrelište i talište, što ih čini korisnim kao kriogena rashladna sredstva.
Prijelazni metali
- Elementi u skupinama 3-12 su prijelazni elementi.
- Svi su metali.
- Većina prijelaznih elemenata nalazi se u kombinaciji s drugim elementima u rudama.
- Nekoliko prijelaznih elemenata kao što su zlato i srebro nalaze se kao čisti elementi.
- Žarulje žarulja izrađene su od volframa (element 74) koji ima najvišu točku taljenja od svih metala i neće se rastopiti kada kroz njega prođe struja.
- Živa, koja ima najnižu točku taljenja od svih metala, koristi se u termometrima i barometrima.
- Živa je jedini metal koji je tekućina na sobnoj temperaturi.
Željezna trijada
Tri elementa u skupini 4 – željezo, kobalt i nikal – imaju toliko slična svojstva da su poznata kao željezna trijada.
Platinasta grupa
Rutenij, rodij, paladij, osmij, iridij i platina ponekad se nazivaju platinskom skupinom jer imaju slična svojstva. Ne kombiniraju se lako s drugim elementima. Kao rezultat toga, mogu se koristiti kao katalizatori.
Unutarnji prijelazni elementi
Neki prijelazni elementi, koji se nazivaju unutarnji prijelazni elementi, nalaze se ispod glavne tablice. Ti se elementi nazivaju nizom lantanida i aktinida jer jedan niz slijedi element lantan, element 57, a drugi niz slijedi aktinij, element 89.
Lantanidi - Prva serija, od cerija do lutecija, naziva se lantanidi. Lantanidi se također nazivaju rijetkom zemljom jer se jedno vrijeme smatralo da su rijetki. To su mekani metali koji se mogu rezati nožem.
Aktinidi – Svi aktinidi su radioaktivni. Torij, protaktinij i uran su jedini aktinidi koji se sada prirodno nalaze na Zemlji. Svi ostali aktinidi su sintetski elementi. Sintetski elementi izrađuju se u laboratorijima i nuklearnim reaktorima.
