Tabel periodik unsur-unsur kimia adalah daftar unsur-unsur yang diketahui. Dalam tabel, unsur-unsur ditempatkan dalam urutan nomor atomnya dimulai dari nomor terendah. Nomor atom suatu unsur sama dengan jumlah proton dalam atom tersebut.
Dmitri Mendeleev mendapat pujian karena merancang tabel periodik modern.
Setiap elemen memiliki kuadrat dalam tabel periodik. Ada 3 buah informasi di setiap kotak
- nama elemen
- simbol kimia resminya
- nomor atomnya
Misalnya, persegi untuk besi akan terlihat seperti ini:
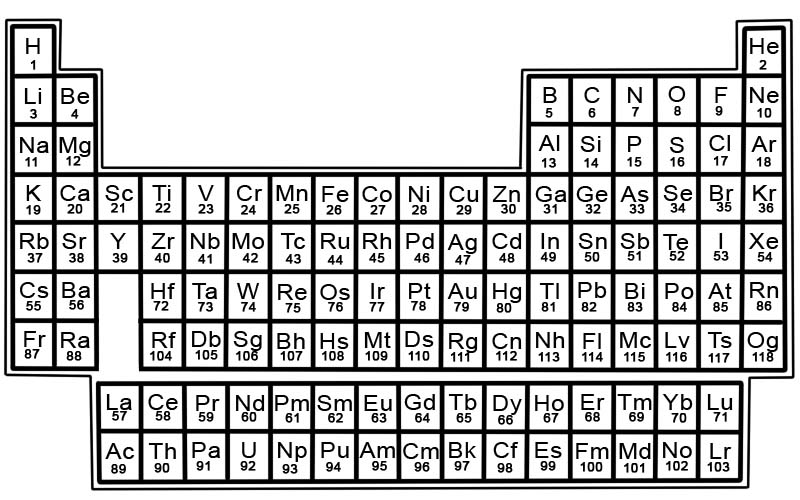
Unsur-unsur dalam tabel periodik disusun dalam baris dan kolom.
- Baris disebut titik. Periode adalah deretan unsur-unsur dalam tabel periodik yang sifat-sifatnya berubah secara bertahap dan dapat diprediksi.
- Kolom disebut grup. Tabel periodik memiliki 18 kolom unsur. Setiap kolom berisi grup, atau keluarga, elemen. Suatu golongan mengandung unsur-unsur yang memiliki sifat fisik atau kimia yang mirip.
Zona pada tabel periodik
Tabel periodik dapat dibagi menjadi beberapa bagian.
Satu bagian terdiri dari dua grup pertama, Grup 1 dan 2, dan elemen di Grup 3-18. Ini adalah elemen perwakilan. Mereka termasuk logam, metaloid, dan bukan logam.
Logam
Contoh: besi, timah, natrium, dan plutonium.
- biasanya padat pada suhu kamar (merkuri merupakan pengecualian)
- kilau tinggi (mengkilap)
- penampilan metalik
- penghantar panas dan listrik yang baik
- lunak (dapat ditekuk dan ditumbuk menjadi lembaran tipis)
- ulet (dapat ditarik menjadi kawat)
- menimbulkan korosi atau oksidasi di udara dan air laut
- biasanya padat (pengecualian meliputi litium, kalium, dan natrium)
- mungkin memiliki titik leleh yang sangat tinggi
- mudah kehilangan elektron
Metaloid
Contoh: boron, silikon, dan arsenik.
- kusam atau mengkilap
- biasanya menghantarkan panas dan listrik, meskipun tidak sebaik logam
- sering membuat semikonduktor yang baik
- sering ada dalam beberapa bentuk
- sering ulet
- sering lunak
- dapat memperoleh atau kehilangan elektron dalam reaksi
Bukan logam
Contoh: oksigen, klorin, dan argon.
- penampilan kusam
- biasanya rapuh
- penghantar panas dan listrik yang buruk
- biasanya kurang padat, dibandingkan dengan logam
- titik leleh padatan biasanya rendah, dibandingkan dengan logam
- cenderung mendapatkan elektron dalam reaksi kimia
Grup 1 dan 2
- Grup 1 - Logam alkali. Contoh: natrium, litium, dan kalium.
- Golongan 2 - Logam alkali tanah Contoh: berilium, magnesium, kalsium, barium, dan radium. Setiap logam alkali tanah lebih padat dan keras serta memiliki titik leleh yang lebih tinggi daripada logam alkali dalam periode yang sama. Logam alkali tanah bersifat reaktif tetapi tidak reaktif seperti logam alkali.
Grup 13 sampai 18
Grup 13 – Keluarga Boron
- Contoh: boron (B), aluminium (Al), galium (Ga), indium (In), dan talium (Tl).
- Mereka memiliki tiga elektron valensi.
Grup 14 – Keluarga karbon
- Contoh: karbon (C), silikon (Si), germanium (Ge), timah (Sn), dan timbal (Pb).
- Mereka semua memiliki empat elektron valensi.
Grup 15 – Keluarga nitrogen
- Contoh: nitrogen (N), fosfor (P), arsen (As), antimon (Sb), dan bismut (Bi).
- Unsur-unsur ini semua memiliki lima elektron valensi.
- Nitrogen dan Fosfor adalah non-logam.
Grup 16 – Keluarga Oksigen
- Contoh: oksigen (O), belerang (S), selenium (Se), telurium (Te), dan polonium radioaktif (Po).
- Golongan ini memiliki enam elektron valensi
- Ini juga dikenal sebagai chalcogens.
Grup 17 – Halogen
- Contoh: fluor (F), klorin (Cl), brom (Br), yodium (I), dan astatin (At).
- Mereka memiliki tujuh elektron valensi.
- Golongan ini adalah yang pertama yang seluruhnya terdiri dari non-logam.
- Halogen sangat reaktif, dan dengan demikian dapat berbahaya atau mematikan organisme biologis dalam jumlah yang cukup.
- Simbol X sering digunakan secara umum untuk merujuk pada halogen apa pun.
- Nama "halogen" berarti "penghasil garam". Ketika halogen bereaksi dengan logam, mereka menghasilkan berbagai macam garam, termasuk kalsium, fluorida, natrium klorida (garam meja), perak bromida, dan kalium iodida.
Grup 18 – Gas mulia
- Ada enam gas mulia - helium, neon, argon, kripton, xenon, dan radon.
- Mereka semua gas dan ditemukan di udara. Mereka membentuk sekitar 0,96% dari atmosfer.
- Semuanya monoatomik, artinya setiap molekul adalah atom tunggal.
- Mereka hampir tidak pernah bereaksi dengan elemen lain. Ini karena mereka memiliki kulit elektron terluar 8 elektron penuh.
- Gas mulia memiliki titik didih dan titik leleh yang sangat rendah, yang membuatnya berguna sebagai pendingin kriogenik.
Logam transisi
- Unsur-unsur di Golongan 3-12 adalah unsur transisi.
- Mereka semua adalah logam.
- Sebagian besar unsur transisi ditemukan berkombinasi dengan unsur lain dalam bijih.
- Beberapa unsur transisi seperti emas dan perak ditemukan sebagai unsur murni.
- Filamen bola lampu terbuat dari tungsten (elemen 74) yang memiliki titik leleh tertinggi dari semua logam dan tidak akan meleleh saat arus melewatinya.
- Merkuri, yang memiliki titik leleh terendah dari semua logam, digunakan dalam termometer dan barometer.
- Merkuri adalah satu-satunya logam yang berbentuk cair pada suhu kamar.
Triad besi
Tiga unsur dalam golongan 4 - besi, kobalt, dan nikel - memiliki sifat yang mirip sehingga dikenal sebagai triad besi.
Grup platina
Ruthenium, rhodium, paladium, osmium, iridium, dan platina terkadang disebut golongan platina karena memiliki sifat yang mirip. Mereka tidak mudah digabungkan dengan elemen lain. Akibatnya, mereka dapat digunakan sebagai katalis.
Elemen transisi batin
Beberapa elemen transisi, yang disebut elemen transisi dalam, ditempatkan di bawah tabel utama. Unsur-unsur ini disebut deret lantanida dan aktinida karena satu deret mengikuti unsur lantanum, unsur 57, dan deret lainnya mengikuti aktinium, unsur 89.
Lantanida - Seri pertama, dari serium ke lutetium, disebut lantanida. Lantanida juga disebut tanah jarang karena pernah dianggap langka. Mereka adalah logam lunak yang dapat dipotong dengan pisau.
Aktinida – Semua aktinida bersifat radioaktif. Torium, protaktinium, dan uranium adalah satu-satunya aktinida yang sekarang ditemukan secara alami di Bumi. Semua aktinida lainnya adalah unsur sintetik. Elemen sintetis dibuat di laboratorium dan reaktor nuklir.
