La tavola periodica degli elementi chimici è un elenco di elementi conosciuti. Nella tabella, gli elementi sono disposti in ordine di numero atomico partendo dal numero più basso. Il numero atomico di un elemento è uguale al numero di protoni in quel particolare atomo.
A Dmitri Mendeleev va il merito di aver ideato la moderna tavola periodica.
Ogni elemento ha un quadrato nella tavola periodica. Ci sono 3 informazioni in ogni quadrato
- il nome dell'elemento
- il suo simbolo chimico ufficiale
- il suo numero atomico
Ad esempio, il quadrato per il ferro sarà un po' così:
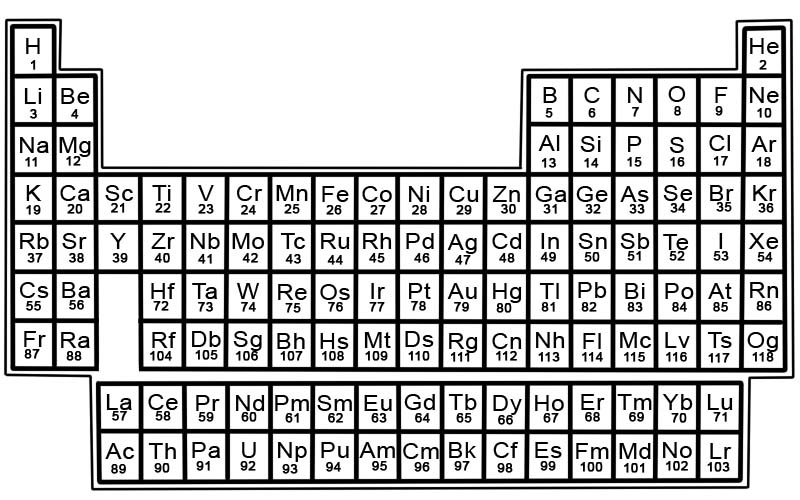
Gli elementi della tavola periodica sono disposti in righe e colonne.
- Le righe sono chiamate periodi. Un periodo è una riga di elementi nella tavola periodica le cui proprietà cambiano gradualmente e in modo prevedibile.
- Le colonne sono chiamate gruppi. La tavola periodica ha 18 colonne di elementi. Ogni colonna contiene un gruppo, o famiglia, di elementi. Un gruppo contiene elementi che hanno proprietà fisiche o chimiche simili.
Zone della tavola periodica
La tavola periodica può essere suddivisa in sezioni.
Una sezione è composta dai primi due gruppi, Gruppo 1 e 2, e dagli elementi dei Gruppi 3-18. Questi sono gli elementi rappresentativi. Includono metalli, metalloidi e non metalli.
Metalli
Esempi: ferro, stagno, sodio e plutonio.
- solitamente solido a temperatura ambiente (il mercurio è un'eccezione)
- alta lucentezza (brillante)
- aspetto metallico
- buoni conduttori di calore ed elettricità
- malleabile (può essere piegato e battuto in fogli sottili)
- duttile (può essere disegnato in filo)
- corrodersi o ossidarsi in aria e acqua di mare
- solitamente denso (le eccezioni includono litio, potassio e sodio)
- può avere un punto di fusione molto alto
- perdono facilmente elettroni
Metalloidi
Esempi: boro, silicio e arsenico.
- opaco o lucido
- di solito conducono calore ed elettricità, anche se non così bene come i metalli
- spesso fanno buoni semiconduttori
- esistono spesso in diverse forme
- spesso duttile
- spesso malleabile
- può guadagnare o perdere elettroni nelle reazioni
Non metalli
Esempi: ossigeno, cloro e argon.
- aspetto opaco
- solitamente fragile
- cattivi conduttori di calore ed elettricità
- solitamente meno denso, rispetto ai metalli
- di solito basso punto di fusione dei solidi, rispetto ai metalli
- tendono ad acquistare elettroni nelle reazioni chimiche
Gruppi 1 e 2
- Gruppo 1 - Metalli alcalini. Esempi: sodio, litio e potassio.
- Gruppo 2 - Metalli alcalino terrosi Esempi: berillio, magnesio, calcio, bario e radio. Ogni metallo alcalino terroso è più denso e più duro e ha un punto di fusione più alto rispetto al metallo alcalino nello stesso periodo. I metalli alcalino terrosi sono reattivi ma non così reattivi come i metalli alcalini.
Gruppi da 13 a 18
Gruppo 13 – Famiglia del boro
- Esempi: boro (B), alluminio (Al), gallio (Ga), indio (In) e tallio (Tl).
- Hanno tre elettroni di valenza.
Gruppo 14 – Famiglia del carbonio
- Esempi: carbonio (C), silicio (Si), germanio (Ge), stagno (Sn) e piombo (Pb).
- Hanno tutti quattro elettroni di valenza.
Gruppo 15 – Famiglia dell'azoto
- Esempi: azoto (N), fosforo (P), arsenico (As), antimonio (Sb) e bismuto (Bi).
- Questi elementi hanno tutti cinque elettroni di valenza.
- L'azoto e il fosforo sono non metalli.
Gruppo 16 – Famiglia dell'ossigeno
- Esempi: ossigeno (O), zolfo (S), selenio (Se), tellurio (Te) e polonio radioattivo (Po).
- Questo gruppo ha sei elettroni di valenza
- Questi sono anche conosciuti come i calcogeni.
Gruppo 17 – Alogeni
- Esempi: fluoro (F), cloro (Cl), bromo (Br), iodio (I) e astato (At).
- Hanno sette elettroni di valenza.
- Questo gruppo è il primo a consistere interamente di non metalli.
- Gli alogeni sono altamente reattivi e come tali possono essere dannosi o letali per gli organismi biologici in quantità sufficienti.
- Il simbolo X è spesso usato genericamente per riferirsi a qualsiasi alogeno.
- Il nome "alogeno" significa "produttore di sale". Quando gli alogeni reagiscono con i metalli, producono un'ampia gamma di sali, tra cui calcio, fluoruro, cloruro di sodio (sale da cucina), bromuro d'argento e ioduro di potassio.
Gruppo 18 – Gas nobili
- Esistono sei gas nobili: elio, neon, argon, krypton, xeno e radon.
- Sono tutti gas e si trovano nell'aria. Costituiscono circa lo 0,96% dell'atmosfera.
- Tutti loro sono monoatomici, il che significa che ogni molecola è un singolo atomo.
- Non reagiscono quasi mai con altri elementi. Questo perché hanno un guscio elettronico esterno completo di 8 elettroni.
- I gas nobili hanno punti di ebollizione e fusione molto bassi, che li rendono utili come refrigeranti criogenici.
Metalli di transizione
- Gli elementi nei gruppi 3-12 sono elementi di transizione.
- Sono tutti metalli.
- La maggior parte degli elementi di transizione si trova combinata con altri elementi nei minerali.
- Alcuni elementi di transizione come l'oro e l'argento si trovano come elementi puri.
- I filamenti delle lampadine sono fatti di tungsteno (elemento 74) che ha il più alto punto di fusione di qualsiasi metallo e non si scioglierà se attraversato da una corrente.
- Il mercurio, che ha il punto di fusione più basso di qualsiasi metallo, viene utilizzato nei termometri e nei barometri.
- Il mercurio è l'unico metallo liquido a temperatura ambiente.
Triade di ferro
Tre elementi del gruppo 4 - ferro, cobalto e nichel - hanno proprietà così simili da essere conosciuti come la triade del ferro.
Gruppo di platino
Rutenio, rodio, palladio, osmio, iridio e platino sono talvolta chiamati gruppo del platino perché hanno proprietà simili. Non si combinano facilmente con altri elementi. Di conseguenza, possono essere utilizzati come catalizzatori.
Elementi di transizione interni
Alcuni elementi di transizione, chiamati elementi di transizione interni, sono posizionati sotto la tabella principale. Questi elementi sono chiamati serie di lantanidi e attinidi perché una serie segue l'elemento lantanio, elemento 57, e l'altra serie segue l'attinio, elemento 89.
Lantanidi - La prima serie, dal cerio al lutezio, è chiamata lantanidi. I lantanidi sono anche chiamati terre rare perché un tempo si pensava che fossero scarsi. Sono metalli teneri che possono essere tagliati con un coltello.
Attinidi - Tutti gli attinidi sono radioattivi. Torio, protoattinio e uranio sono gli unici attinidi che ora si trovano naturalmente sulla Terra. Tutti gli altri attinidi sono elementi sintetici. Gli elementi sintetici sono prodotti nei laboratori e nei reattori nucleari.
