化学元素の周期表は、既知の元素のリストです。この表では、元素は原子番号の小さい順に配置されています。元素の原子番号は、その特定の原子の陽子の数と同じです。
ドミトリー・メンデレーエフは、現代の周期表を設計した功績を認められています。
各要素には、周期表の正方形があります。各マスには 3 つの情報があります
たとえば、鉄の正方形は次のようになります。
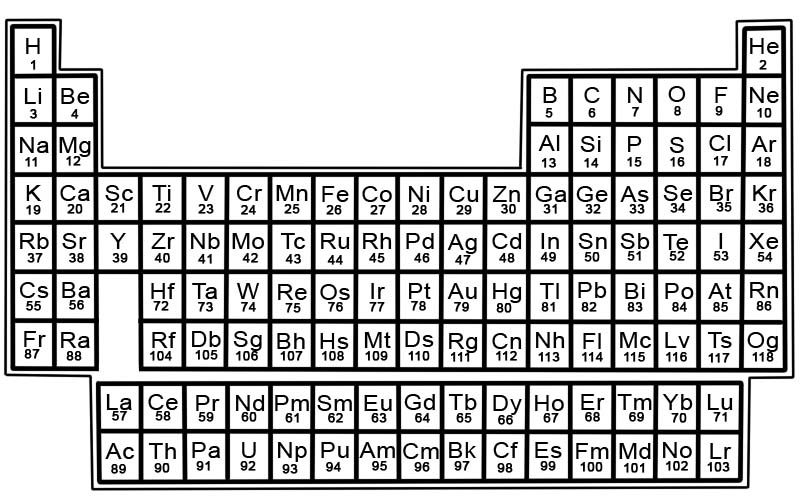
周期表の要素は、行と列に配置されています。
- 行はピリオドと呼ばれます。周期は、周期表の要素の列であり、その特性は徐々に予測可能に変化します。
- 列はグループと呼ばれます。周期表には 18 列の元素があります。各列には、要素のグループまたはファミリが含まれています。グループには、類似した物理的または化学的特性を持つ要素が含まれています。
周期表のゾーン
周期表はセクションに分けることができます。
1 つのセクションは、最初の 2 つのグループ、グループ 1 と 2、およびグループ 3 ~ 18 の要素で構成されます。これらが代表的な要素です。それらには、金属、半金属、および非金属が含まれます。
金属
例: 鉄、スズ、ナトリウム、プルトニウム。
- 通常、室温で固体(水銀は例外)
- 高光沢(光沢)
- メタリックな外観
- 熱と電気の良導体
- 可鍛性(曲げて薄いシートに叩くことができます)
- 延性(ワイヤーに引き込むことができます)
- 空気中および海水中で腐食または酸化する
- 通常は高密度(リチウム、カリウム、ナトリウムは例外)
- 非常に高い融点を持つ可能性があります
- 容易に電子を失う
半金属
例: ホウ素、シリコン、ヒ素。
- 鈍いまたは光沢のある
- 通常、熱と電気を伝導しますが、金属ほどではありません
- 多くの場合、良い半導体を作る
- 多くの場合、いくつかの形で存在します
- しばしば延性
- しばしば可鍛性
- 反応で電子を獲得または失う可能性があります
非金属
例: 酸素、塩素、およびアルゴン。
- 鈍い外観
- 通常脆い
- 熱と電気の悪い導体
- 通常、金属と比較して密度が低い
- 通常、金属と比較して固体の融点が低い
- 化学反応で電子を獲得する傾向がある
グループ 1 と 2
- グループ 1 - アルカリ金属。例: ナトリウム、リチウム、カリウム。
- グループ 2 - アルカリ土類金属 例: ベリリウム、マグネシウム、カルシウム、バリウム、およびラジウム。各アルカリ土類金属は、同時期のアルカリ金属よりも密度が高く、より硬く、融点が高くなります。アルカリ土類金属は反応性がありますが、アルカリ金属ほど反応しません。
グループ13~18
グループ 13 – ホウ素族
- 例: ホウ素 (B)、アルミニウム (Al)、ガリウム (Ga)、インジウム (In)、およびタリウム (Tl)。
- それらは 3 つの価電子を持っています。
グループ 14 – 炭素ファミリー
- 例: 炭素 (C)、シリコン (Si)、ゲルマニウム (Ge)、スズ (Sn)、鉛 (Pb)。
- それらはすべて 4 つの価電子を持っています。
グループ 15 – 窒素ファミリー
- 例: 窒素 (N)、リン (P)、ヒ素 (As)、アンチモン (Sb)、およびビスマス (Bi)。
- これらの元素はすべて 5 つの価電子を持っています。
- 窒素とリンは非金属です。
グループ 16 – 酸素ファミリー
- 例: 酸素 (O)、硫黄 (S)、セレン (Se)、テルル (Te)、および放射性ポロニウム (Po)。
- このグループには6つの価電子があります
- これらはカルコゲンとしても知られています。
グループ 17 – ハロゲン
- 例: フッ素 (F)、塩素 (Cl)、臭素 (Br)、ヨウ素 (I)、およびアスタチン (At)。
- それらは7つの価電子を持っています。
- このグループは、完全に非金属で構成される最初のグループです。
- ハロゲンは非常に反応性が高く、大量に存在すると生物に有害または致命的になる可能性があります。
- 記号 X は、ハロゲンを表すために一般的に使用されることがよくあります。
- 「ハロゲン」という名前は「塩を生成する」という意味です。ハロゲンが金属と反応すると、カルシウム、フッ化物、塩化ナトリウム(食卓塩)、臭化銀、ヨウ化カリウムなど、さまざまな塩が生成されます。
グループ 18 – 希ガス
- 希ガスには、ヘリウム、ネオン、アルゴン、クリプトン、キセノン、ラドンの 6 種類があります。
- それらはすべて気体であり、空気中に存在します。それらは大気の約0.96%を占めています。
- それらはすべて単原子です。つまり、各分子は単一の原子です。
- それらは他の要素とほとんど反応しません。これは、完全に 8 個の電子の外側電子殻を持っているためです。
- 希ガスは沸点と融点が非常に低いため、極低温冷媒として役立ちます。
遷移金属
- グループ 3 ~ 12 の要素は遷移要素です。
- それらはすべて金属です。
- ほとんどの遷移元素は、鉱石内で他の元素と結合して見つかります。
- 金や銀などのいくつかの遷移元素は、純元素として発見されています。
- 電球のフィラメントは、金属の中で最も融点が高く、電流を流しても溶けないタングステン(元素番号74)でできています。
- 水銀は金属の中で最も融点が低く、温度計や気圧計に使われています。
- 水銀は、室温で液体である唯一の金属です。
アイアントライアド
グループ 4 の 3 つの元素 - 鉄、コバルト、およびニッケル - は、鉄のトライアドとして知られている非常に類似した特性を持っています。
プラチナグループ
ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム、白金は、性質が似ていることから白金族と呼ばれることがあります。それらは他の要素と容易に結合しません。その結果、それらは触媒として使用することができます。
内部遷移要素
内部遷移要素と呼ばれる一部の遷移要素は、メイン テーブルの下に配置されます。これらの元素は、ランタニド系列とアクチニド系列と呼ばれます。これは、一方の系列が元素ランタンの元素 57 に続き、もう一方の系列が元素 89 のアクチニウムに続くためです。
ランタニド- セリウムからルテチウムまでの最初のシリーズは、ランタニドと呼ばれます。ランタニドは希土類とも呼ばれ、かつては希少であると考えられていました。それらはナイフで切ることができる柔らかい金属です。
アクチニド- すべてのアクチニドは放射性です。トリウム、プロタクチニウム、およびウランは、現在地球上で自然に発見されている唯一のアクチニドです。他のすべてのアクチニドは合成元素です。合成元素は実験室や原子炉で作られます。
