Периодичниот систем на хемиските елементи е список на познати елементи. Во табелата, елементите се поставени по редослед на нивните атомски броеви, почнувајќи од најнискиот број. Атомскиот број на елемент е ист како и бројот на протони во тој атом.
Дмитриј Менделеев добива заслуги за дизајнирање на современата периодична маса.
Секој елемент има квадрат во периодниот систем. На секој плоштад има по 3 информации
- името на елементот
- неговиот официјален хемиски симбол
- неговиот атомски број
На пример, плоштадот за железо ќе изгледа малку вака:
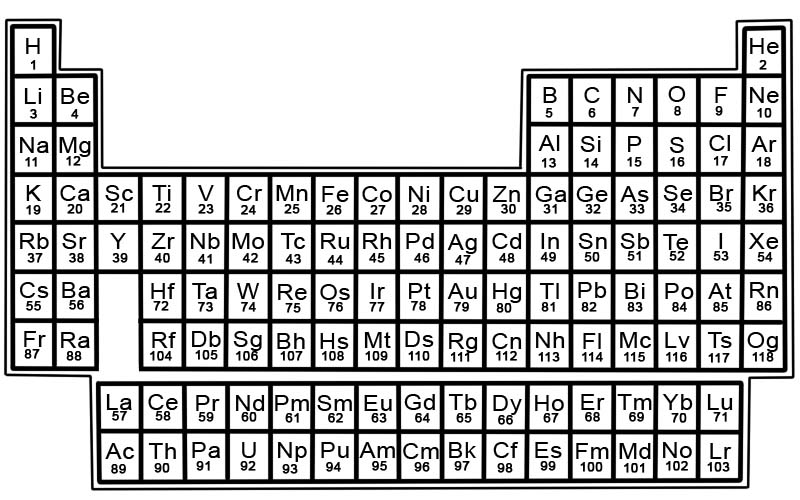
Елементите во периодниот систем се распоредени во редови и колони.
- Редовите се нарекуваат периоди. Период е ред на елементи во периодичниот систем чии својства се менуваат постепено и предвидливо.
- Колоните се нарекуваат групи. Периодичниот систем има 18 колони елементи. Секоја колона содржи група, или семејство, од елементи. Група содржи елементи кои имаат слични физички или хемиски својства.
Зони на периодниот систем
Периодичниот систем може да се подели на делови.
Еден дел се состои од првите две групи, Група 1 и 2, и елементите во Групите 3-18. Ова се репрезентативни елементи. Тие вклучуваат метали, металоиди и неметали.
Метали
Примери: железо, калај, натриум и плутониум.
- обично цврст на собна температура (живата е исклучок)
- висок сјај (сјаен)
- метален изглед
- добри спроводници на топлина и електрична енергија
- податлив (може да се свитка и удри во тенки листови)
- еластичен (може да се вовлече во жица)
- кородираат или оксидираат во воздухот и морската вода
- обично густа (исклучоците вклучуваат литиум, калиум и натриум)
- може да има многу висока точка на топење
- лесно губат електрони
Металоиди
Примери: бор, силициум и арсен.
- досадна или сјајна
- обично спроведуваат топлина и електрична енергија, но не и метали
- често прават добри полупроводници
- често постојат во неколку форми
- често дуктилни
- често податлив
- може да добие или изгуби електрони при реакции
Неметали
Примери: кислород, хлор и аргон.
- досаден изглед
- обично кршливи
- слаби спроводници на топлина и електрична енергија
- обично помалку густа, во споредба со металите
- обично мала точка на топење на цврстите материи, во споредба со металите
- имаат тенденција да добиваат електрони при хемиски реакции
Групи 1 и 2
- Група 1 - Алкални метали. Примери: натриум, литиум и калиум.
- Група 2 - Алкални земјени метали Примери: берилиум, магнезиум, калциум, бариум и радиум. Секој алкален метал е погуст и поцврст и има поголема точка на топење од алкалниот метал во истиот период. Металите од алкална земја се реактивни, но не се толку реактивни како алкалните метали.
Групи од 13 до 18 години
Група 13 - семејство на бор
- Примери: бор (Б), алуминиум (Ал), галиум (Ga), индиум (In) и талиум (Tl).
- Тие имаат три електрони на валентност.
Група 14 - семејство на јаглерод
- Примери: јаглерод (C), силициум (Si), германиум (Ge), калај (Sn) и олово (Pb).
- Сите тие имаат четири електрони на валентност.
Група 15 - семејство на азот
- Примери: азот (N), фосфор (P), арсен (како), антимон (Sb) и бизмут (Bi).
- Сите овие елементи имаат пет електрони на валентност.
- Азот и фосфор се неметали.
Група 16 - семејство на кислород
- Примери: кислород (О), сулфур (S), селен (Se), телуриум (Te) и радиоактивен полониум (Po).
- Оваа група има шест електрони на валентност
- Овие се познати и како халкогени.
Група 17 - Халогени
- Примери: флуор (F), хлор (Cl), бром (Br), јод (I) и астатин (At).
- Тие имаат седум електрони на валентност.
- Оваа група е прва што се состои од целосно неметали.
- Халогените се многу реактивни и како такви можат да бидат штетни или смртоносни за биолошките организми во доволни количини.
- Симболот Х честопати се користи генерички за да се однесува на кој било халоген.
- Името „халоген“ значи „производство на сол“. Кога халогените реагираат со метали, тие создаваат широк спектар на соли, вклучувајќи калциум, флуор, натриум хлорид (трпезариска сол), сребро бромид и калиум јодид.
Група 18 - благородни гасови
- Постојат шест благородни гасови - хелиум, неон, аргон, криптон, ксенон и радон.
- Сите тие се гасови и се наоѓаат во воздухот. Тие сочинуваат околу 0,96% од атмосферата.
- Сите тие се моноатомски, што значи дека секоја молекула е еден атом.
- Тие скоро никогаш не реагираат со други елементи. Тоа е затоа што тие имаат целосна 8 електрони надворешна електронска обвивка.
- Благородните гасови имаат многу ниски точки на вриење и топење, што ги прави корисни како криогени ладилни средства.
Преодни метали
- Елементите во Групите 3-12 се транзициони елементи.
- Сите тие се метали.
- Повеќето елементи на транзиција се наоѓаат во комбинација со други елементи во рудите.
- Неколку елементи на транзиција, како што се златото и среброто, се наоѓаат како чисти елементи.
- Филаментите на сијалиците се направени од волфрам (елемент 74) кој има највисока точка на топење од кој било метал и нема да се стопи кога струја поминува низ неа.
- Меркур, кој има најниска точка на топење од сите други метали, се користи во термометри и барометри.
- Меркур е единствениот метал што е течност на собна температура.
Ironелезна тријада
Три елементи во групата 4 - железо, кобалт и никел - имаат такви слични својства што се познати како железна тријада.
Група од платина
Рутениум, родиум, паладиум, осмиум, иридиум и платина понекогаш се нарекуваат група на платина затоа што имаат слични својства. Тие не се комбинираат лесно со други елементи. Како резултат, тие можат да се користат како катализатори.
Внатрешни елементи на транзиција
Некои елементи на транзиција, наречени внатрешни елементи на транзиција, се поставени под главната табела. Овие елементи се нарекуваат лантанидни и актинидни серии затоа што едната серија го следи елементот лантан, елемент 57, а другата серија следи актиниум, елемент 89.
Лантаниди - Првата серија, од цериум до лутетиум, се нарекува лантаниди. Лантанидите исто така се нарекуваат ретка земја бидејќи едно време се сметало дека се малку. Тие се меки метали што можат да се исечат со нож.
Актиниди - сите актиниди се радиоактивни. Ториум, протактиниум и ураниум се единствените актиниди кои сега се наоѓаат природно на Земјата. Сите други актиниди се синтетички елементи. Синтетички елементи се прават во лаборатории и нуклеарни реактори.
