ဓာတုဒြပ်စင်များ၏ အလှည့်ကျဇယားသည် လူသိများသော ဒြပ်စင်များစာရင်းဖြစ်သည်။ ဇယားတွင်၊ ဒြပ်စင်များကို အနိမ့်ဆုံးနံပါတ်ဖြင့် စတင်သည့် ၎င်းတို့၏ အက်တမ်နံပါတ်များ အစဉ်လိုက် ထားရှိထားသည်။ ဒြပ်စင်တစ်ခု၏ အက်တမ်နံပါတ်သည် ထိုအက်တမ်ရှိ ပရိုတွန်အရေအတွက်နှင့် တူညီသည်။
Dmitri Mendeleev သည် ခေတ်မီအချိန်ဇယားဇယားကို ဒီဇိုင်းရေးဆွဲခြင်းအတွက် ခရက်ဒစ်ရရှိသည်။
ဒြပ်စင်တစ်ခုစီတွင် အလှည့်ကျဇယားတွင် စတုရန်းတစ်ခုစီရှိသည်။ စတုရန်းတစ်ခုစီတွင် အချက်အလက် 3 ခုရှိသည်။
- ဒြပ်စင်၏အမည်
- ၎င်း၏တရားဝင်ဓာတုသင်္ကေတ
- ၎င်း၏ အက်တမ်နံပါတ်
ဥပမာ၊ သံအတွက် စတုရန်းပုံသည် ဤကဲ့သို့ အနည်းငယ်မြင်ရလိမ့်မည်-
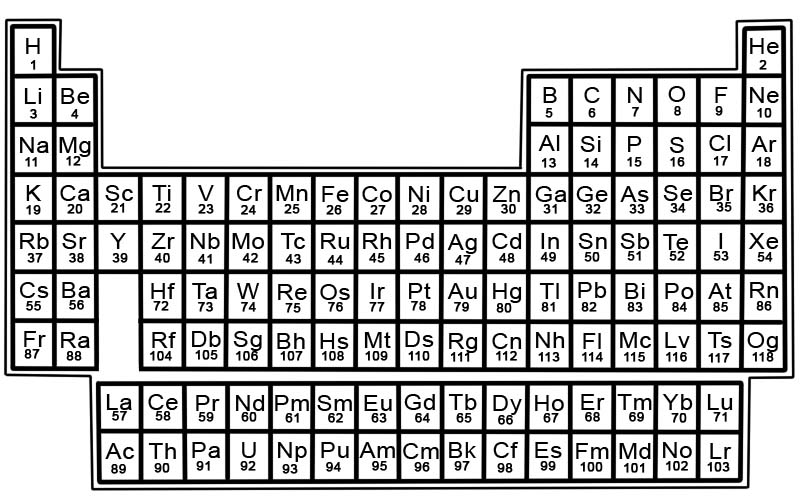
Periodic Table မှဒြပ်စင်များကို အတန်းများနှင့် ကော်လံများဖြင့် စီစဉ်ထားပါသည်။
- အတန်းများကို ကာလအပိုင်းအခြားဟုခေါ်သည်။ ကာလတစ်ခုသည် အလှည့်ကျဇယားရှိ ဒြပ်စင်အတန်းတစ်ခုဖြစ်ပြီး ဂုဏ်သတ္တိများ တဖြည်းဖြည်းပြောင်းလဲကာ ကြိုတင်မှန်းဆနိုင်သည်။
- ကော်လံများကို အုပ်စုများဟုခေါ်သည်။ Periodic Table တွင် ဒြပ်စင် ကော်လံ 18 ခု ရှိသည်။ ကော်လံတစ်ခုစီတွင် ဒြပ်စင်အုပ်စုတစ်စု သို့မဟုတ် မိသားစုများပါရှိသည်။ အုပ်စုတစ်ခုတွင် အလားတူရုပ်ပိုင်းဆိုင်ရာ သို့မဟုတ် ဓာတုဂုဏ်သတ္တိများရှိသော ဒြပ်စင်များ ပါရှိသည်။
အပိုင်းဇယားပေါ်ရှိ ဇုန်များ
Periodic Table ကို အပိုင်းများ ခွဲခြားနိုင်သည်။
အပိုင်းတစ်ခုတွင် ပထမအုပ်စုနှစ်စု၊ အုပ်စု 1 နှင့် 2 နှင့် အုပ်စု 3-18 ရှိ အစိတ်အပိုင်းများ ပါဝင်သည်။ ဤအရာများသည် ကိုယ်စားပြုအင်္ဂါရပ်များဖြစ်သည်။ ၎င်းတို့တွင် သတ္တုများ၊ metalloids နှင့် nonmetals များ ပါဝင်သည်။
သတ္တုများ
ဥပမာ- သံ၊ သံဖြူ၊ ဆိုဒီယမ်နှင့် ပလူတိုနီယမ်။
- များသောအားဖြင့် အခန်းအပူချိန်တွင် အခဲများ (ပြဒါးသည် ချွင်းချက်တစ်ခုဖြစ်သည်)
- တောက်ပသော (တောက်ပြောင်)
- သတ္တုအသွင်အပြင်
- ကောင်းသောအပူနှင့်လျှပ်စစ်လျှပ်စစ်ပစ္စည်း
- ပျော့ပြောင်းနိုင်သော (ကွေးညွှတ်ပြီး အလွှာများအဖြစ် ထောင်းနိုင်သည်)
- ductile (ဝါယာကြိုးဖြင့်ဆွဲနိုင်သည်)
- လေနှင့် ပင်လယ်ရေတို့တွင် ဖော့ သို့မဟုတ် ဓာတ်တိုးစေသည်။
- အများအားဖြင့် သိပ်သည်းမှု (ခြွင်းချက်အနေနဲ့ လစ်သီယမ်၊ ပိုတက်စီယမ်နဲ့ ဆိုဒီယမ်တို့ ပါဝင်ပါတယ်)
- အလွန်မြင့်မားသော အရည်ပျော်မှတ် ဖြစ်နိုင်သည်။
- အီလက်ထရွန်များ အလွယ်တကူ ဆုံးရှုံးနိုင်သည်။
သတ္တုဓာတ်
ဥပမာ- ဘိုရွန်၊ ဆီလီကွန်နှင့် အာဆင်းနစ်။
- မှိုင်း သို့မဟုတ် တောက်ပြောင်သည်။
- သတ္တုများကဲ့သို့မဟုတ်သော်လည်း အပူနှင့်လျှပ်စစ်ကို သယ်ဆောင်ပေးလေ့ရှိသည်။
- semiconductors ကောင်းကောင်းတွေ လုပ်တတ်တယ်။
- ပုံစံအမျိုးမျိုးဖြင့် တည်ရှိနေတတ်သည်။
- မကြာခဏ ductile
- ပျော့ပြောင်းတတ်သည်။
- တုံ့ပြန်မှုတွင် အီလက်ထရွန်များ ရရှိခြင်း သို့မဟုတ် ဆုံးရှုံးနိုင်သည်။
သတ္တုမဟုတ်သော
ဥပမာ- အောက်ဆီဂျင်၊ ကလိုရင်းနှင့် အာဂွန်။
- မှိုင်းသောအသွင်အပြင်
- ကြွပ်ဆတ်တတ်သည်။
- အပူနှင့်လျှပ်စစ် လျှပ်ကူးပစ္စည်း ညံ့ဖျင်းသည်။
- များသောအားဖြင့် သတ္တုများနှင့် နှိုင်းယှဉ်ပါက သိပ်သည်းမှုနည်းသည်။
- များသောအားဖြင့် သတ္တုများနှင့် နှိုင်းယှဉ်ပါက အစိုင်အခဲများ အရည်ပျော်မှတ်နည်းသည်။
- ဓာတုတုံ့ပြန်မှုတွင် အီလက်ထရွန်များ ရရှိတတ်သည်။
အုပ်စု ၁ နှင့် ၂
- အုပ်စု 1 - အယ်လ်ကာလီသတ္တုများ။ ဥပမာ- ဆိုဒီယမ်၊ လစ်သီယမ် နှင့် ပိုတက်စီယမ်။
- အုပ်စု 2 - အယ်လ်ကာလိုင်းမြေသတ္ထုများ ဥပမာများ- ဘီရီလီယမ်၊ မဂ္ဂနီဆီယမ်၊ ကယ်လ်စီယမ်၊ ဘေရီယမ် နှင့် ရေဒီယမ်။ အယ်ကာလိုင်းမြေသတ္ထုတစ်ခုစီသည် ပိုမိုသိပ်သည်းပြီး မာကျောပြီး တစ်ချိန်တည်းတွင် အယ်လ်ကာလီသတ္တုထက် အရည်ပျော်မှတ်ပိုများသည်။ အယ်ကာလိုင်းမြေကြီးသတ္တုများသည် ဓာတ်ပြုသော်လည်း အယ်ကာလီသတ္တုများကဲ့သို့ ဓာတ်မတည့်ပါ။
အုပ်စု ၁၃ မှ ၁၈
အုပ်စု 13 – ဘိုရွန်မိသားစု
- ဥပမာ- ဘိုရွန် (B)၊ အလူမီနီယမ် (Al)၊ ဂါလီယမ် (Ga)၊ အင်ဒီယမ် (In) နှင့် သာလီယမ် (Tl)။
- ၎င်းတို့တွင် valence electron သုံးခုရှိသည်။
အုပ်စု ၁၄ – ကာဗွန်မိသားစု
- ဥပမာ- ကာဗွန် (C)၊ ဆီလီကွန် (Si)၊ ဂျာမနီယမ် (Ge)၊ သံဖြူ (Sn) နှင့် ခဲ (Pb)။
- ၎င်းတို့အားလုံးတွင် valence အီလက်ထရွန် လေးခုရှိသည်။
အုပ်စု 15 - နိုက်ထရိုဂျင် မိသားစု
- ဥပမာ- နိုက်ထရိုဂျင် (N)၊ ဖော့စဖရပ် (P)၊ အာဆင်းနစ် (As)၊ ခနောက်စိမ်း (Sb) နှင့် ဘစ်မတ် (Bi)။
- ဤဒြပ်စင်များအားလုံးတွင် valence အီလက်ထရွန်ငါးခုရှိသည်။
- နိုက်ထရိုဂျင်နှင့် ဖော့စဖရပ်စ်တို့သည် သတ္တုမဟုတ်ပေ။
အုပ်စု ၁၆ – အောက်ဆီဂျင် မိသားစု
- ဥပမာ- အောက်ဆီဂျင် (O)၊ ဆာလဖာ (S)၊ ဆယ်လီနီယမ် (Se)၊ Tellurium (Te) နှင့် ရေဒီယိုသတ္တိကြွ ပိုလိုနီယမ် (Po)။
- ဤအုပ်စုတွင် valence အီလက်ထရွန် ခြောက်ခုရှိသည်။
- ဒါတွေကို chalcogens လို့လည်း ခေါ်တယ်။
အုပ်စု 17 - ဟေလိုဂျင်
- ဥပမာ- ဖလိုရင်း (F)၊ ကလိုရင်း (Cl)၊ ဘရိုမင် (Br)၊ အိုင်အိုဒင်း (I)၊ နှင့် အက်စတာတင်း (At)။
- ၎င်းတို့တွင် valence အီလက်ထရွန် ခုနစ်လုံးရှိသည်။
- ဤအုပ်စုသည် သတ္တုမဟုတ်သော လုံး၀ပါဝင်သည့် ပထမဆုံးအုပ်စုဖြစ်သည်။
- ဟေလိုဂျင်များသည် ဓာတ်ပြုမှု အလွန်မြင့်မားသောကြောင့် လုံလောက်သောပမာဏဖြင့် ဇီဝသက်ရှိများကို အန္တရာယ်ဖြစ်စေနိုင် သို့မဟုတ် သေစေနိုင်သည်။
- ဟေလိုဂျင်တစ်ခုခုကိုရည်ညွှန်းရန်အတွက် X သင်္ကေတကို ယေဘူယျအားဖြင့် အသုံးပြုလေ့ရှိသည်။
- “ဟလိုဂျင်” ဟူသည် “ဆားထုတ်လုပ်သည်” ဟု အဓိပ္ပာယ်ရသည်။ ဟေလိုဂျင်သည် သတ္တုများနှင့် ဓာတ်ပြုသောအခါတွင် ကယ်လ်စီယမ်၊ ဖလိုရိုက်၊ ဆိုဒီယမ်ကလိုရိုက် (စားပွဲတင်ဆား)၊ ငွေဘရိုမိုက်နှင့် ပိုတက်စီယမ်အိုင်အိုဒိုက် အပါအဝင် ဆားအများအပြားကို ထုတ်လုပ်သည်။
အုပ်စု 18 - Noble ဓာတ်ငွေ့
- မြင့်မြတ်သော ဓာတ်ငွေ့ခြောက်မျိုး - ဟီလီယမ်၊ နီယွန်၊ အာဂွန်၊ ကရစ်ပတွန်၊ ဇီနွန်နှင့် ရေဒွန်။
- ၎င်းတို့အားလုံးသည် ဓာတ်ငွေ့များဖြစ်ပြီး လေထဲတွင် တွေ့ရှိကြသည်။ ၎င်းတို့သည် လေထု၏ 0.96% ဝန်းကျင်ဖြစ်သည်။
- ၎င်းတို့အားလုံးသည် monoatomic ဖြစ်သောကြောင့် မော်လီကျူးတစ်ခုစီသည် အက်တမ်တစ်ခုစီဖြစ်သည်။
- ၎င်းတို့သည် အခြားဒြပ်စင်များနှင့် တုံ့ပြန်မှု လုံးဝနီးပါး မရှိပါ။ အဘယ်ကြောင့်ဆိုသော် ၎င်းတို့တွင် အီလက်ထရွန် ၈ လုံး အပြည့်ရှိသောကြောင့် ဖြစ်သည်။
- Noble ဓာတ်ငွေ့များသည် ဆူပွက်မှုနှင့် အရည်ပျော်မှတ်များ အလွန်နည်းပြီး ၎င်းတို့ကို အအေးခန်း အအေးခန်းများအဖြစ် အသုံးဝင်စေသည်။
အကူးအပြောင်း သတ္တုများ
- အုပ်စု 3-12 ရှိ ဒြပ်စင်များသည် အကူးအပြောင်းဒြပ်စင်များဖြစ်သည်။
- ၎င်းတို့အားလုံးသည် သတ္တုများဖြစ်သည်။
- အကူးအပြောင်းဒြပ်စင်အများစုကို သတ္တုရိုင်းများတွင် အခြားဒြပ်စင်များနှင့် ပေါင်းစပ်တွေ့ရှိရသည်။
- ရွှေနှင့် ငွေကဲ့သို့သော အသွင်ကူးပြောင်းရေးဒြပ်စင်အချို့ကို သန့်စင်သောဒြပ်စင်များအဖြစ် တွေ့ရှိရသည်။
- မီးသီးများ၏ အမျှင်များသည် tungsten (ဒြပ်စင် 74) ဖြင့် ပြုလုပ်ထားပြီး မည်သည့်သတ္တု၏ အမြင့်ဆုံး အရည်ပျော်မှတ် ရှိပြီး ၎င်းကို ဖြတ်သန်းသွားသည့်အခါ အရည်ပျော်မည်မဟုတ်ပါ။
- သတ္တုတိုင်း၏ အနိမ့်ဆုံး အရည်ပျော်မှတ်ရှိသော မာကျူရီကို သာမိုမီတာနှင့် ဘာရိုမီတာများတွင် အသုံးပြုသည်။
- မာကျူရီသည် အခန်းအပူချိန်တွင် အရည်ရှိသော တစ်ခုတည်းသောသတ္တုဖြစ်သည်။
သံ triad
အုပ်စု 4 တွင် သံ၊ ကိုဘော့နှင့် နီကယ်- သံဓာတ်သုံးမျိုးတွင် သံ triad ဟုခေါ်သော အလားတူဂုဏ်သတ္တိများရှိသည်။
ပလက်တီနမ်အုပ်စု
Ruthenium၊ rhodium၊ palladium၊ osmium၊ iridium နှင့် platinum တို့ကို တခါတရံတွင် ပလက်တီနမ်အုပ်စုတွင် အလားတူ ဂုဏ်သတ္တိရှိသောကြောင့် ခေါ်ဝေါ်ကြသည်။ ၎င်းတို့သည် အခြားဒြပ်စင်များနှင့် အလွယ်တကူ ပေါင်းစပ်ခြင်းမရှိပေ။ ရလဒ်အနေဖြင့် ၎င်းတို့ကို ဓာတ်ကူပစ္စည်းအဖြစ် အသုံးပြုနိုင်သည်။
အတွင်းအကူးအပြောင်း အစိတ်အပိုင်းများ
အတွင်းအသွင်ကူးပြောင်းရေးဒြပ်စင်များဟုခေါ်သော အသွင်ကူးပြောင်းရေးဒြပ်စင်အချို့ကို ပင်မဇယားအောက်တွင် ထားရှိထားသည်။ ဤဒြပ်စင်များကို lanthanide နှင့် actinide စီးရီးဟု ခေါ်ဝေါ်ရခြင်းမှာ စီးရီးတစ်ခုသည် လန်သနမ်ဒြပ်စင်၊ ဒြပ်စင် 57 နှင့် အခြားစီးရီးတစ်ခုသည် actinium၊ ဒြပ်စင် 89 ကို လိုက်နာသောကြောင့် ဖြစ်သည်။
Lanthanides - စီရီယမ်မှ လူတက်တီယမ်အထိ ပထမစီးရီးကို Lanthanides ဟုခေါ်သည်။ လန်သနိုက်များကို ရှားပါးမြေကြီးဟုလည်း တစ်ချိန်က တွေးထင်ခဲ့ကြသောကြောင့် ဖြစ်သည်။ ၎င်းတို့သည် ဓားဖြင့်ဖြတ်နိုင်သော ပျော့ပျောင်းသောသတ္တုများဖြစ်သည်။
Actinides - actinides အားလုံးသည် ရေဒီယိုသတ္တိကြွများဖြစ်သည်။ သိုရီယမ်၊ ပရိုတက်တီနီယမ်နှင့် ယူရေနီယမ်တို့သည် ယခုအခါ ကမ္ဘာပေါ်တွင် သဘာဝအတိုင်း တွေ့ရှိနိုင်သည့် တစ်ခုတည်းသော အက်တီနီယမ်များဖြစ်သည်။ အခြား actinides အားလုံးသည် ဓာတုဒြပ်စင်များဖြစ်သည်။ ဓာတုဒြပ်စင်များကို ဓာတ်ခွဲခန်းများနှင့် အဏုမြူဓာတ်ပေါင်းဖိုများတွင် ပြုလုပ်သည်။
