रासायनिक तत्वहरूको आवधिक तालिका ज्ञात तत्वहरूको सूची हो। तालिकामा, तत्वहरूलाई तिनीहरूको आणविक सङ्ख्याको क्रममा सबैभन्दा कम सङ्ख्याबाट सुरु गरी राखिएको छ। कुनै तत्वको परमाणु संख्या त्यो विशेष परमाणुमा प्रोटोनहरूको संख्या जस्तै हो।
आधुनिक आवधिक तालिका डिजाइन गर्ने श्रेय दिमित्री मेन्डेलिभलाई दिइन्छ।
आवधिक तालिकामा प्रत्येक तत्वको वर्ग हुन्छ। प्रत्येक वर्गमा जानकारीको 3 टुक्राहरू छन्
- तत्व को नाम
- यसको आधिकारिक रासायनिक प्रतीक
- यसको परमाणु संख्या
उदाहरण को लागी, फलाम को लागी वर्ग यो जस्तो देखिन्छ:
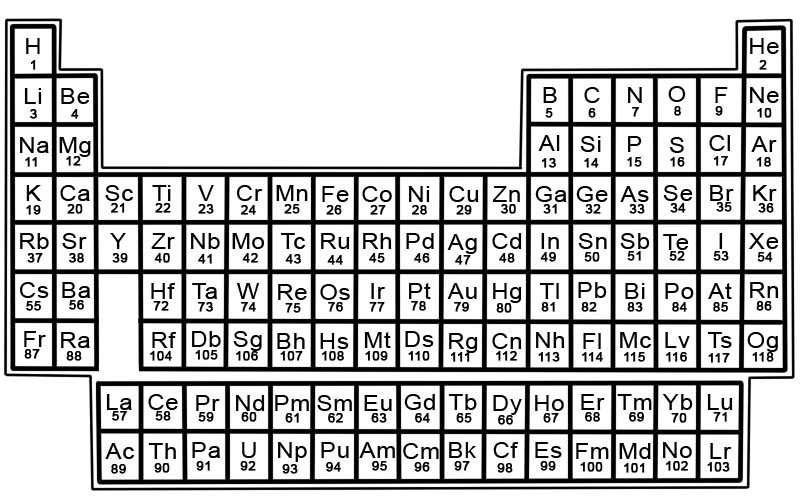
आवधिक तालिकाका तत्वहरू पङ्क्ति र स्तम्भहरूमा व्यवस्थित छन्।
- पङ्क्तिहरूलाई अवधि भनिन्छ। अवधि भनेको आवधिक तालिकामा तत्वहरूको पङ्क्ति हो जसको गुणहरू क्रमशः र अनुमानित रूपमा परिवर्तन हुन्छन्।
- स्तम्भहरूलाई समूह भनिन्छ। आवधिक तालिकामा तत्वहरूको 18 स्तम्भहरू छन्। प्रत्येक स्तम्भले तत्वहरूको समूह, वा परिवार समावेश गर्दछ। समूहमा समान भौतिक वा रासायनिक गुणहरू भएका तत्वहरू हुन्छन्।
आवधिक तालिकामा क्षेत्रहरू
आवधिक तालिकालाई खण्डहरूमा विभाजन गर्न सकिन्छ।
एउटा खण्डमा पहिलो दुई समूहहरू, समूह 1 र 2, र समूह 3-18 मा तत्वहरू हुन्छन्। यी प्रतिनिधि तत्वहरू हुन्। तिनीहरूमा धातुहरू, धातुहरू, र गैर-धातुहरू समावेश छन्।
धातुहरू
उदाहरणहरू: फलाम, टिन, सोडियम, र प्लुटोनियम।
- सामान्यतया कोठाको तापमानमा ठोस (पारा एक अपवाद हो)
- उच्च चमक (चमकदार)
- धातु उपस्थिति
- गर्मी र बिजुली को राम्रो चालक
- निन्दनीय (बार्न सकिन्छ र पातलो पानाहरूमा ठोक्न सकिन्छ)
- नरम (तारमा तान्न सकिन्छ)
- हावा र समुद्री पानीमा कोरोड वा अक्सिडाइज गर्नुहोस्
- सामान्यतया घना (अपवादहरू लिथियम, पोटासियम र सोडियम समावेश गर्दछ)
- धेरै उच्च पिघलने बिन्दु हुन सक्छ
- सजिलै इलेक्ट्रोन हराउन
Metalloids
उदाहरणहरू: बोरोन, सिलिकन, र आर्सेनिक।
- सुस्त वा चमकदार
- सामान्यतया तातो र बिजुली सञ्चालन गर्दछ, यद्यपि धातुहरू जस्तै होइन
- अक्सर राम्रो अर्धचालक बनाउँछ
- अक्सर धेरै रूप मा अवस्थित
- अक्सर नम्र
- अक्सर निन्दनीय
- प्रतिक्रियाहरूमा इलेक्ट्रोनहरू प्राप्त गर्न वा गुमाउन सक्छ
गैरधातुहरू
उदाहरणहरू: अक्सिजन, क्लोरीन र आर्गन।
- सुस्त उपस्थिति
- सामान्यतया भंगुर
- गर्मी र बिजुली को गरीब कंडक्टर
- सामान्यतया कम घना, धातुहरूको तुलनामा
- सामान्यतया धातुको तुलनामा ठोस पदार्थको कम पिघलने बिन्दु
- रासायनिक प्रतिक्रियाहरूमा इलेक्ट्रोनहरू प्राप्त गर्ने प्रवृत्ति
समूह १ र २
- समूह १ - अल्काली धातुहरू। उदाहरणहरू: सोडियम, लिथियम, र पोटासियम।
- समूह २ - क्षारीय पृथ्वी धातुहरू उदाहरणहरू: बेरिलियम, म्याग्नेसियम, क्याल्सियम, बेरियम, र रेडियम। प्रत्येक क्षारीय पृथ्वी धातु सघन र कडा छ र समान अवधिमा क्षारी धातु भन्दा उच्च पग्लने बिन्दु छ। क्षारीय पृथ्वी धातुहरू प्रतिक्रियाशील छन् तर क्षारी धातुहरू जस्तै प्रतिक्रियाशील छैनन्।
समूह 13 देखि 18 सम्म
समूह 13 - बोरोन परिवार
- उदाहरणहरू: बोरोन (बी), एल्युमिनियम (अल), ग्यालियम (गा), इन्डियम (इन), र थालियम (टीएल)।
- तिनीहरूसँग तीन भ्यालेन्स इलेक्ट्रोनहरू छन्।
समूह 14 - कार्बन परिवार
- उदाहरणहरू: कार्बन (C), सिलिकन (Si), जर्मेनियम (Ge), टिन (Sn), र सीसा (Pb)।
- तिनीहरू सबैसँग चारवटा भ्यालेन्स इलेक्ट्रोनहरू छन्।
समूह 15 - नाइट्रोजन परिवार
- उदाहरणहरू: नाइट्रोजन (N), फस्फोरस (P), आर्सेनिक (As), एन्टिमोनी (Sb), र बिस्मथ (Bi)।
- यी सबै तत्वहरूमा पाँच भ्यालेन्स इलेक्ट्रोनहरू छन्।
- नाइट्रोजन र फस्फोरस गैर धातु हुन्।
समूह 16 - अक्सिजन परिवार
- उदाहरणहरू: अक्सिजन (O), सल्फर (S), सेलेनियम (Se), टेलुरियम (Te), र रेडियोधर्मी पोलोनियम (Po)।
- यो समूहमा छवटा भ्यालेन्स इलेक्ट्रोनहरू छन्
- यी पनि chalcogens भनेर चिनिन्छ।
समूह 17 - हलोजन
- उदाहरणहरू: फ्लोरिन (F), क्लोरीन (Cl), ब्रोमिन (Br), आयोडिन (I), र astatine (At)।
- तिनीहरूसँग सात भ्यालेन्स इलेक्ट्रोनहरू छन्।
- यो समूह पूर्ण रूपमा गैर-धातुहरू समावेश गर्ने पहिलो समूह हो।
- हलोजेनहरू अत्यधिक प्रतिक्रियाशील हुन्छन्, र त्यसरी पर्याप्त मात्रामा जैविक जीवहरूको लागि हानिकारक वा घातक हुन सक्छ।
- प्रतीक X प्रायः सामान्य रूपमा कुनै पनि हलोजनलाई सन्दर्भ गर्न प्रयोग गरिन्छ।
- नाम "ह्यालोजन" को अर्थ "नुनको उत्पादन" हो। जब हलोजेनहरूले धातुहरूसँग प्रतिक्रिया गर्छन् तिनीहरूले क्याल्सियम, फ्लोराइड, सोडियम क्लोराइड (टेबल नुन), सिल्भर ब्रोमाइड र पोटासियम आयोडाइड सहित लवणहरूको विस्तृत श्रृंखला उत्पादन गर्छन्।
समूह 18 - नोबल ग्याँसहरू
- त्यहाँ छवटा महान ग्यासहरू छन् - हेलियम, नियोन, आर्गन, क्रिप्टन, क्सीनन र रेडोन।
- ती सबै ग्यास हुन् र हावामा पाइन्छ। तिनीहरू वायुमण्डलको लगभग 0.96% बनाउँछन्।
- ती सबै मोनोएटोमिक हुन्, जसको अर्थ प्रत्येक अणु एकल परमाणु हो।
- तिनीहरू प्राय: अन्य तत्वहरूसँग प्रतिक्रिया गर्दैनन्। यो किनभने तिनीहरूसँग पूर्ण 8 इलेक्ट्रोन बाहिरी इलेक्ट्रोन शेल छ।
- नोबल ग्याँसहरूमा धेरै कम उमाल्ने र पग्लने बिन्दुहरू छन्, जसले तिनीहरूलाई क्रायोजेनिक रेफ्रिजरेन्टको रूपमा उपयोगी बनाउँछ।
संक्रमण धातुहरू
- समूह 3-12 मा तत्वहरू संक्रमण तत्वहरू हुन्।
- तिनीहरू सबै धातुहरू हुन्।
- धेरैजसो संक्रमण तत्वहरू अयस्कहरूमा अन्य तत्वहरूसँग मिलेर पाइन्छ।
- सुन र चाँदी जस्ता केही संक्रमण तत्वहरू शुद्ध तत्वहरूको रूपमा पाइन्छ।
- लाइट बल्बका फिलामेन्टहरू टंगस्टन (तत्व 74) बाट बनेका हुन्छन् जसमा कुनै पनि धातुको उच्चतम पग्लने बिन्दु हुन्छ र यसबाट करेन्ट गुजर्दा पग्लिने छैन।
- बुध, जुन कुनै पनि धातुको सबैभन्दा कम पग्लने बिन्दु छ, थर्मोमिटर र ब्यारोमिटरहरूमा प्रयोग गरिन्छ।
- बुध एकमात्र धातु हो जुन कोठाको तापक्रममा तरल पदार्थ हो।
फलामको ट्राइड
समूह 4 मा तीन तत्वहरू - फलाम, कोबाल्ट, र निकल - यस्तो समान गुणहरू छन् कि तिनीहरूलाई फलाम ट्रायड भनिन्छ।
प्लेटिनम समूह
रुथेनियम, रोडियम, प्यालेडियम, ओस्मियम, इरिडियम र प्लेटिनमलाई कहिलेकाहीँ प्लेटिनम समूह भनिन्छ किनभने तिनीहरूसँग समान गुणहरू छन्। तिनीहरू अन्य तत्वहरूसँग सजिलै संयोजन गर्दैनन्। फलस्वरूप, तिनीहरू उत्प्रेरक रूपमा प्रयोग गर्न सकिन्छ।
आन्तरिक संक्रमण तत्वहरू
केही संक्रमण तत्वहरू, भित्री संक्रमण तत्वहरू भनिन्छ, मुख्य तालिका तल राखिएको छ। यी तत्वहरूलाई ल्यान्थानाइड र एक्टिनाइड श्रृंखला भनिन्छ किनभने एउटा शृङ्खलाले एलिमेन्ट ल्यान्थानम, एलिमेन्ट 57, र अर्को श्रृङ्खलाले एक्टिनियम, तत्व 89 लाई पछ्याउँछ।
Lanthanides - पहिलो श्रृंखला, cerium देखि lutetium सम्म, lanthanides भनिन्छ। ल्यान्थानाइडलाई दुर्लभ पृथ्वी पनि भनिन्छ किनभने कुनै समय तिनीहरू दुर्लभ मानिन्थ्यो। तिनीहरू नरम धातुहरू हुन् जुन चाकूले काट्न सकिन्छ।
एक्टिनाइड्स - सबै एक्टिनाइडहरू रेडियोधर्मी हुन्छन्। थोरियम, प्रोटाक्टिनियम, र युरेनियम मात्र एक्टिनाइडहरू हुन् जुन अहिले पृथ्वीमा प्राकृतिक रूपमा पाइन्छ। अन्य सबै एक्टिनाइड्स सिंथेटिक तत्व हुन्। सिंथेटिक तत्वहरू प्रयोगशालाहरू र आणविक रिएक्टरहरूमा बनाइन्छ।
