Het periodiek systeem van de chemische elementen is een lijst van bekende elementen. In de tabel zijn de elementen in volgorde van hun atoomnummer geplaatst, beginnend met het laagste nummer. Het atoomnummer van een element is hetzelfde als het aantal protonen in dat specifieke atoom.
Dmitri Mendelejev krijgt de eer voor het ontwerpen van het moderne periodiek systeem.
Elk element heeft een vierkant in het periodiek systeem. Er zijn 3 stukjes informatie in elk vierkant
- de naam van het element
- zijn officiële chemische symbool
- zijn atoomnummer
Het vierkant voor ijzer ziet er bijvoorbeeld een beetje als volgt uit:
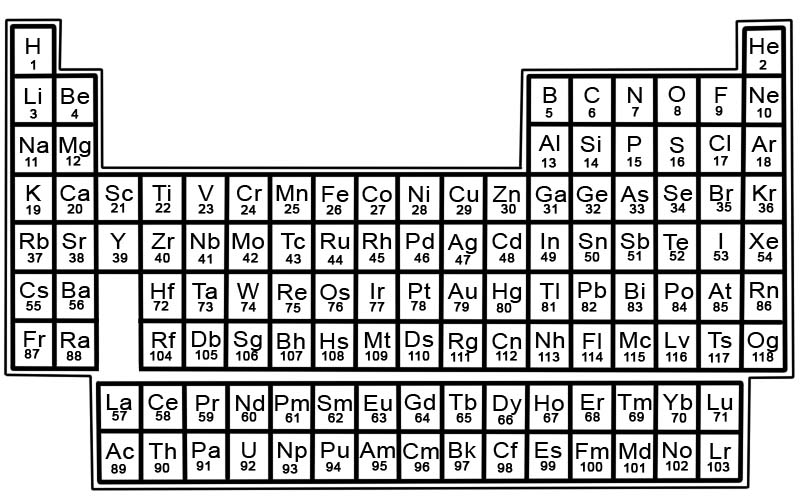
Elementen in het periodiek systeem zijn gerangschikt in rijen en kolommen.
- Rijen worden perioden genoemd. Een periode is een rij elementen in het periodiek systeem waarvan de eigenschappen geleidelijk en voorspelbaar veranderen.
- Kolommen worden groepen genoemd. Het periodiek systeem heeft 18 kolommen met elementen. Elke kolom bevat een groep of familie van elementen. Een groep bevat elementen die vergelijkbare fysische of chemische eigenschappen hebben.
Zones op het periodiek systeem
Het periodiek systeem kan worden onderverdeeld in secties.
Een sectie bestaat uit de eerste twee groepen, Groep 1 en 2, en de elementen in Groepen 3-18. Dit zijn de representatieve elementen. Ze omvatten metalen, metalloïden en niet-metalen.
metalen
Voorbeelden: ijzer, tin, natrium en plutonium.
- meestal vast bij kamertemperatuur (kwik is een uitzondering)
- hoge glans (glanzend)
- metalen uiterlijk
- goede geleiders van warmte en elektriciteit
- kneedbaar (kan worden gebogen en gestampt tot dunne platen)
- ductiel (kan in draad worden getrokken)
- corroderen of oxideren in lucht en zeewater;
- meestal dicht (uitzonderingen zijn lithium, kalium en natrium)
- kan een zeer hoog smeltpunt hebben
- gemakkelijk elektronen verliezen
Metalloïden
Voorbeelden: boor, silicium en arseen.
- dof of glanzend
- geleiden gewoonlijk warmte en elektriciteit, hoewel niet zo goed als metalen
- maken vaak goede halfgeleiders
- bestaan vaak in verschillende vormen
- vaak kneedbaar
- vaak kneedbaar
- kan elektronen winnen of verliezen in reacties
niet-metalen
Voorbeelden: zuurstof, chloor en argon.
- saai uiterlijk
- meestal broos
- slechte geleiders van warmte en elektriciteit
- meestal minder dicht, vergeleken met metalen
- meestal laag smeltpunt van vaste stoffen, vergeleken met metalen
- hebben de neiging om elektronen te winnen in chemische reacties
Groepen 1 en 2
- Groep 1 - Alkalimetalen. Voorbeelden: natrium, lithium en kalium.
- Groep 2 - Aardalkalimetalen Voorbeelden: beryllium, magnesium, calcium, barium en radium. Elk aardalkalimetaal is dichter en harder en heeft een hoger smeltpunt dan het alkalimetaal in dezelfde periode. Aardalkalimetalen zijn reactief, maar niet zo reactief als alkalimetalen.
Groepen 13 tot 18
Groep 13 – Boriumfamilie
- Voorbeelden: boor (B), aluminium (Al), gallium (Ga), indium (In) en thallium (Tl).
- Ze hebben drie valentie-elektronen.
Groep 14 – Koolstoffamilie
- Voorbeelden: koolstof (C), silicium (Si), germanium (Ge), tin (Sn) en lood (Pb).
- Ze hebben allemaal vier valentie-elektronen.
Groep 15 – Stikstoffamilie
- Voorbeelden: stikstof (N), fosfor (P), arseen (As), antimoon (Sb) en bismut (Bi).
- Deze elementen hebben allemaal vijf valentie-elektronen.
- Stikstof en fosfor zijn niet-metalen.
Groep 16 – Zuurstoffamilie
- Voorbeelden: zuurstof (O), zwavel (S), selenium (Se), tellurium (Te) en radioactief polonium (Po).
- Deze groep heeft zes valentie-elektronen
- Deze worden ook wel de chalcogenen genoemd.
Groep 17 – Halogenen
- Voorbeelden: fluor (F), chloor (Cl), broom (Br), jodium (I) en astatine (At).
- Ze hebben zeven valentie-elektronen.
- Deze groep is de eerste die volledig uit niet-metalen bestaat.
- Halogenen zijn zeer reactief en kunnen als zodanig in voldoende hoeveelheden schadelijk of dodelijk zijn voor biologische organismen.
- Het symbool X wordt vaak algemeen gebruikt om te verwijzen naar halogeen.
- De naam "halogeen" betekent "zoutproducerend". Wanneer halogenen reageren met metalen, produceren ze een breed scala aan zouten, waaronder calcium, fluoride, natriumchloride (keukenzout), zilverbromide en kaliumjodide.
Groep 18 – Edelgassen
- Er zijn zes edelgassen: helium, neon, argon, krypton, xenon en radon.
- Het zijn allemaal gassen en komen voor in de lucht. Ze vormen ongeveer 0,96% van de atmosfeer.
- Ze zijn allemaal monoatomisch, wat betekent dat elk molecuul een enkel atoom is.
- Ze reageren bijna nooit met andere elementen. Dit komt omdat ze een volledige buitenste elektronenschil van 8 elektronen hebben.
- Edelgassen hebben een zeer laag kook- en smeltpunt, waardoor ze bruikbaar zijn als cryogene koelmiddelen.
Overgangsmetalen
- De elementen in de groepen 3-12 zijn overgangselementen.
- Het zijn allemaal metalen.
- De meeste overgangselementen worden gecombineerd met andere elementen in ertsen gevonden.
- Een paar overgangselementen zoals goud en zilver worden als pure elementen teruggevonden.
- De gloeidraden van gloeilampen zijn gemaakt van wolfraam (element 74) dat het hoogste smeltpunt van alle metalen heeft en niet zal smelten als er stroom doorheen gaat.
- Kwik, dat het laagste smeltpunt heeft van alle metalen, wordt gebruikt in thermometers en barometers.
- Kwik is het enige metaal dat bij kamertemperatuur vloeibaar is.
IJzeren triade
Drie elementen in groep 4 - ijzer, kobalt en nikkel - hebben zulke vergelijkbare eigenschappen dat ze bekend staan als de ijzertriade.
Platina groep
Ruthenium, rhodium, palladium, osmium, iridium en platina worden soms de platinagroep genoemd omdat ze vergelijkbare eigenschappen hebben. Ze zijn niet gemakkelijk te combineren met andere elementen. Daardoor kunnen ze als katalysator worden gebruikt.
Innerlijke overgangselementen
Sommige overgangselementen, de binnenste overgangselementen genoemd, worden onder de hoofdtabel geplaatst. Deze elementen worden de lanthanide- en actinidereeksen genoemd omdat de ene reeks volgt op het element lanthaan, element 57, en de andere reeks volgt op actinium, element 89.
Lanthaniden - De eerste serie, van cerium tot lutetium, wordt de lanthaniden genoemd. De lanthaniden worden ook wel de zeldzame aarde genoemd omdat men ooit dacht dat ze schaars waren. Het zijn zachte metalen die met een mes kunnen worden gesneden.
Actiniden - Alle actiniden zijn radioactief. Thorium, protactinium en uranium zijn de enige actiniden die nu van nature op aarde worden aangetroffen. Alle andere actiniden zijn synthetische elementen. Synthetische elementen worden gemaakt in laboratoria en kernreactoren.
