Układ okresowy pierwiastków chemicznych to lista znanych pierwiastków. W tabeli pierwiastki są ułożone w kolejności ich liczb atomowych, zaczynając od najniższej liczby. Liczba atomowa pierwiastka jest taka sama jak liczba protonów w tym konkretnym atomie.
Dmitrijowi Mendelejewowi przypisuje się zaprojektowanie nowoczesnego układu okresowego pierwiastków.
Każdy pierwiastek ma kwadrat w układzie okresowym. W każdym kwadracie znajdują się 3 informacje
- nazwa elementu
- jego oficjalny symbol chemiczny
- jego liczba atomowa
Na przykład kwadrat dla żelaza będzie wyglądał mniej więcej tak:
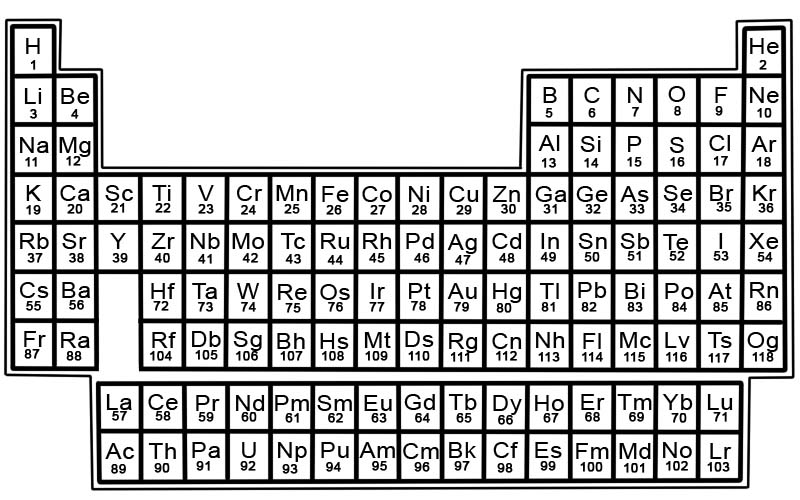
Pierwiastki w układzie okresowym są ułożone w rzędy i kolumny.
- Wiersze nazywane są kropkami. Okres to rząd pierwiastków w układzie okresowym, których właściwości zmieniają się stopniowo i w przewidywalny sposób.
- Kolumny nazywane są grupami. Układ okresowy zawiera 18 kolumn pierwiastków. Każda kolumna zawiera grupę lub rodzinę elementów. Grupa zawiera elementy, które mają podobne właściwości fizyczne lub chemiczne.
Strefy w układzie okresowym
Układ okresowy można podzielić na sekcje.
Jedna sekcja składa się z dwóch pierwszych grup, grupy 1 i 2, oraz elementów z grup 3-18. To elementy reprezentatywne. Należą do nich metale, metaloidy i niemetale.
Metale
Przykłady: żelazo, cyna, sód i pluton.
- zwykle ciało stałe w temperaturze pokojowej (wyjątek stanowi rtęć)
- wysoki połysk (błyszczący)
- metaliczny wygląd
- dobrymi przewodnikami ciepła i elektryczności
- ciągliwy (można go zginać i wbijać w cienkie arkusze)
- plastyczny (można go wciągnąć w drut)
- korodują lub utleniają się w powietrzu i wodzie morskiej
- zwykle gęsty (wyjątki obejmują lit, potas i sód)
- może mieć bardzo wysoką temperaturę topnienia
- łatwo gubią elektrony
Metaloidy
Przykłady: bor, krzem i arsen.
- matowe lub błyszczące
- zwykle przewodzą ciepło i elektryczność, choć nie tak dobrze jak metale
- często dobre półprzewodniki
- często występuje w kilku formach
- często plastyczny
- często plastyczny
- może zyskać lub stracić elektrony w reakcjach
niemetale
Przykłady: tlen, chlor i argon.
- matowy wygląd
- zwykle kruche
- słabymi przewodnikami ciepła i elektryczności
- zwykle mniej gęsty w porównaniu z metalami
- zwykle niska temperatura topnienia ciał stałych w porównaniu z metalami
- mają tendencję do pozyskiwania elektronów w reakcjach chemicznych
Grupy 1 i 2
- Grupa 1 - Metale alkaliczne. Przykłady: sód, lit i potas.
- Grupa 2 - Metale ziem alkalicznych Przykłady: beryl, magnez, wapń, bar i rad. Każdy metal ziem alkalicznych jest gęstszy i twardszy oraz ma wyższą temperaturę topnienia niż metal alkaliczny w tym samym okresie. Metale ziem alkalicznych są reaktywne, ale nie tak reaktywne jak metale alkaliczne.
Grupy od 13 do 18
Grupa 13 – Rodzina Borów
- Przykłady: bor (B), glin (Al), gal (Ga), ind (In) i tal (Tl).
- Mają trzy elektrony walencyjne.
Grupa 14 – rodzina Carbon
- Przykłady: węgiel (C), krzem (Si), german (Ge), cyna (Sn) i ołów (Pb).
- Wszystkie mają cztery elektrony walencyjne.
Grupa 15 – Rodzina azotowa
- Przykłady: azot (N), fosfor (P), arsen (As), antymon (Sb) i bizmut (Bi).
- Wszystkie te elementy mają pięć elektronów walencyjnych.
- Azot i fosfor to niemetale.
Grupa 16 – Rodzina tlenowa
- Przykłady: tlen (O), siarka (S), selen (Se), tellur (Te) i radioaktywny polon (Po).
- Ta grupa ma sześć elektronów walencyjnych
- Są one również znane jako chalkogeny.
Grupa 17 – Halogeny
- Przykłady: fluor (F), chlor (Cl), brom (Br), jod (I) i astat (At).
- Mają siedem elektronów walencyjnych.
- Ta grupa jako pierwsza składa się wyłącznie z niemetali.
- Halogeny są wysoce reaktywne i jako takie mogą być szkodliwe lub śmiertelne dla organizmów biologicznych w wystarczających ilościach.
- Symbol X jest często używany ogólnie w odniesieniu do dowolnego halogenu.
- Nazwa „halogen” oznacza „wytwarzający sól”. Kiedy halogeny reagują z metalami, wytwarzają szeroką gamę soli, w tym wapń, fluorek, chlorek sodu (sól kuchenna), bromek srebra i jodek potasu.
Grupa 18 – Gazy szlachetne
- Istnieje sześć gazów szlachetnych – hel, neon, argon, krypton, ksenon i radon.
- Wszystkie są gazami i znajdują się w powietrzu. Stanowią około 0,96% atmosfery.
- Wszystkie są jednoatomowe, co oznacza, że każda cząsteczka jest pojedynczym atomem.
- Prawie nigdy nie reagują z innymi pierwiastkami. Dzieje się tak, ponieważ mają pełną zewnętrzną powłokę elektronową złożoną z 8 elektronów.
- Gazy szlachetne mają bardzo niskie temperatury wrzenia i topnienia, co czyni je przydatnymi jako kriogeniczne czynniki chłodnicze.
Metale przejściowe
- Pierwiastki z grup 3-12 to elementy przejściowe.
- Wszystkie są metalami.
- Większość pierwiastków przejściowych występuje w rudach w połączeniu z innymi pierwiastkami.
- Kilka pierwiastków przejściowych, takich jak złoto i srebro, występuje jako pierwiastki czyste.
- Włókna żarówek wykonane są z wolframu (pierwiastek 74), który ma najwyższą temperaturę topnienia ze wszystkich metali i nie topi się, gdy przepływa przez niego prąd.
- Rtęć, która ma najniższą temperaturę topnienia ze wszystkich metali, jest używana w termometrach i barometrach.
- Rtęć jest jedynym metalem, który jest cieczą w temperaturze pokojowej.
Żelazna triada
Trzy pierwiastki z grupy 4 – żelazo, kobalt i nikiel – mają tak podobne właściwości, że są znane jako triada żelaza.
Platynowa grupa
Ruten, rod, pallad, osm, iryd i platyna są czasami nazywane grupą platynowców, ponieważ mają podobne właściwości. Nie łączą się łatwo z innymi elementami. Dzięki temu mogą być stosowane jako katalizatory.
Wewnętrzne elementy przejściowe
Niektóre elementy przejściowe, zwane wewnętrznymi elementami przejściowymi, są umieszczone poniżej głównej tabeli. Pierwiastki te nazywane są seriami lantanowców i aktynowców, ponieważ jedna seria następuje po pierwiastku lantan, pierwiastek 57, a druga po aktynie, pierwiastek 89.
Lantanowce - pierwsza seria, od ceru do lutetu, nazywana jest lantanowcami. Lantanowce są również nazywane pierwiastkami ziem rzadkich, ponieważ kiedyś uważano je za rzadkie. Są to miękkie metale, które można ciąć nożem.
Aktynowce – Wszystkie aktynowce są radioaktywne. Tor, protaktyn i uran to jedyne aktynowce, które obecnie występują naturalnie na Ziemi. Wszystkie inne aktynowce są pierwiastkami syntetycznymi. Elementy syntetyczne powstają w laboratoriach i reaktorach jądrowych.
