A tabela periódica dos elementos químicos é uma lista de elementos conhecidos. Na tabela, os elementos são colocados na ordem de seus números atômicos começando com o número mais baixo. O número atômico de um elemento é o mesmo que o número de prótons desse átomo em particular.
Dmitri Mendeleev recebe o crédito por projetar a tabela periódica moderna.
Cada elemento tem um quadrado na tabela periódica. Há 3 informações em cada quadrado
- o nome do elemento
- seu símbolo químico oficial
- seu número atômico
Por exemplo, o quadrado do ferro ficará assim:
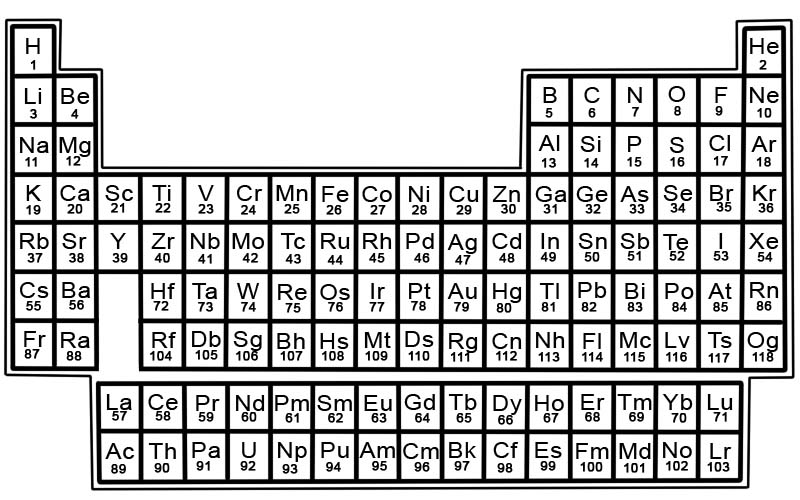
Os elementos da tabela periódica são organizados em linhas e colunas.
- As linhas são chamadas de períodos. Um período é uma linha de elementos na tabela periódica cujas propriedades mudam de forma gradual e previsível.
- As colunas são chamadas de grupos. A tabela periódica tem 18 colunas de elementos. Cada coluna contém um grupo ou família de elementos. Um grupo contém elementos que têm propriedades físicas ou químicas semelhantes.
Zonas da tabela periódica
A tabela periódica pode ser dividida em seções.
Uma seção consiste nos dois primeiros grupos, Grupo 1 e 2, e os elementos nos Grupos 3-18. Esses são os elementos representativos. Eles incluem metais, metalóides e não metais.
Metais
Exemplos: ferro, estanho, sódio e plutônio.
- geralmente sólido à temperatura ambiente (o mercúrio é uma exceção)
- alto brilho (brilhante)
- aparência metálica
- bons condutores de calor e eletricidade
- maleável (pode ser dobrado e batido em folhas finas)
- dúctil (pode ser transformado em fio)
- corroer ou oxidar no ar e na água do mar
- geralmente denso (exceções incluem lítio, potássio e sódio)
- pode ter um ponto de fusão muito alto
- perde elétrons facilmente
Metalóides
Exemplos: boro, silício e arsênico.
- fosco ou brilhante
- geralmente conduzem calor e eletricidade, embora não tão bem quanto os metais
- muitas vezes fazem bons semicondutores
- muitas vezes existem em várias formas
- muitas vezes dúctil
- muitas vezes maleável
- pode ganhar ou perder elétrons em reações
Não-metais
Exemplos: oxigênio, cloro e argônio.
- aparência maçante
- geralmente quebradiço
- maus condutores de calor e eletricidade
- geralmente menos denso, em comparação com os metais
- geralmente baixo ponto de fusão de sólidos, em comparação com metais
- tendem a ganhar elétrons em reações químicas
Grupos 1 e 2
- Grupo 1 - Metais alcalinos. Exemplos: sódio, lítio e potássio.
- Grupo 2 - Metais alcalino-terrosos Exemplos: berílio, magnésio, cálcio, bário e rádio. Cada metal alcalino-terroso é mais denso e mais duro e tem um ponto de fusão mais alto do que o metal alcalino no mesmo período. Os metais alcalino-terrosos são reativos, mas não tão reativos quanto os metais alcalinos.
Grupos 13 a 18
Grupo 13 – Família Boro
- Exemplos: boro (B), alumínio (Al), gálio (Ga), índio (In) e tálio (Tl).
- Possuem três elétrons de valência.
Grupo 14 – Família de carbono
- Exemplos: carbono (C), silício (Si), germânio (Ge), estanho (Sn) e chumbo (Pb).
- Todos eles têm quatro elétrons de valência.
Grupo 15 - Família de nitrogênio
- Exemplos: nitrogênio (N), fósforo (P), arsênio (As), antimônio (Sb) e bismuto (Bi).
- Todos esses elementos têm cinco elétrons de valência.
- Nitrogênio e Fósforo são não-metais.
Grupo 16 - Família de oxigênio
- Exemplos: oxigênio (O), enxofre (S), selênio (Se), telúrio (Te) e polônio radioativo (Po).
- Este grupo tem seis elétrons de valência
- Estes também são conhecidos como os calcogênios.
Grupo 17 - Halogênios
- Exemplos: flúor (F), cloro (Cl), bromo (Br), iodo (I) e astato (At).
- Eles têm sete elétrons de valência.
- Este grupo é o primeiro a consistir inteiramente de não-metais.
- Os halogênios são altamente reativos e, como tal, podem ser prejudiciais ou letais para organismos biológicos em quantidades suficientes.
- O símbolo X é frequentemente usado genericamente para se referir a qualquer halogênio.
- O nome “halogênio” significa “produtor de sal”. Quando os halogênios reagem com metais, eles produzem uma ampla gama de sais, incluindo cálcio, fluoreto, cloreto de sódio (sal de mesa), brometo de prata e iodeto de potássio.
Grupo 18 – Gases nobres
- Existem seis gases nobres – hélio, neônio, argônio, criptônio, xenônio e radônio.
- Eles são todos gases e são encontrados no ar. Eles compõem cerca de 0,96% da atmosfera.
- Todos eles são monoatômicos, o que significa que cada molécula é um único átomo.
- Quase nunca reagem com outros elementos. Isso ocorre porque eles têm uma camada eletrônica externa completa de 8 elétrons.
- Os gases nobres têm pontos de ebulição e fusão muito baixos, o que os torna úteis como refrigerantes criogênicos.
Metais de transição
- Os elementos nos Grupos 3-12 são elementos de transição.
- São todos metais.
- A maioria dos elementos de transição são encontrados combinados com outros elementos em minérios.
- Alguns elementos de transição, como ouro e prata, são encontrados como elementos puros.
- Os filamentos das lâmpadas são feitos de tungstênio (elemento 74) que tem o ponto de fusão mais alto de qualquer metal e não derrete quando uma corrente passa por ele.
- O mercúrio, que tem o ponto de fusão mais baixo de qualquer metal, é usado em termômetros e barômetros.
- O mercúrio é o único metal que é líquido à temperatura ambiente.
Tríade de Ferro
Três elementos do grupo 4 – ferro, cobalto e níquel – têm propriedades tão semelhantes que são conhecidos como a tríade do ferro.
Grupo Platina
Rutênio, ródio, paládio, ósmio, irídio e platina às vezes são chamados de grupo da platina porque têm propriedades semelhantes. Eles não combinam facilmente com outros elementos. Como resultado, eles podem ser usados como catalisadores.
Elementos de transição interna
Alguns elementos de transição, chamados de elementos de transição interna, são colocados abaixo da tabela principal. Esses elementos são chamados de séries de lantanídeos e actinídeos porque uma série segue o elemento lantânio, elemento 57, e a outra série segue o actínio, elemento 89.
Lantanídeos - A primeira série, do cério ao lutécio, é chamada de lantanídeos. Os lantanídeos também são chamados de terras raras porque em uma época eles eram considerados escassos. São metais macios que podem ser cortados com uma faca.
Actinídeos – Todos os actinídeos são radioativos. Tório, protactínio e urânio são os únicos actinídeos que agora são encontrados naturalmente na Terra. Todos os outros actinídeos são elementos sintéticos. Elementos sintéticos são feitos em laboratórios e reatores nucleares.
