Периодическая таблица химических элементов - это список известных элементов. В таблице элементы расположены в порядке их атомных номеров, начиная с наименьшего номера. Атомный номер элемента совпадает с числом протонов в этом конкретном атоме.
Дмитрию Менделееву принадлежит заслуга в разработке современной таблицы Менделеева.
У каждого элемента есть квадрат в периодической таблице. В каждом квадрате есть 3 части информации
- имя элемента
- его официальный химический символ
- его атомный номер
Например, квадрат для железа будет выглядеть примерно так:
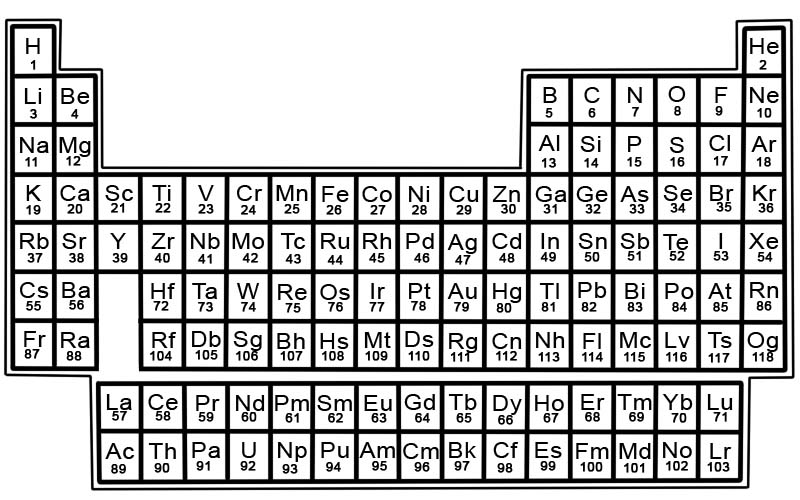
Элементы в периодической таблице расположены в строках и столбцах.
- Строки называются точками. Точка - это ряд элементов в периодической таблице, свойства которых изменяются постепенно и предсказуемо.
- Столбцы называются группами. В периодической таблице 18 столбцов элементов. Каждый столбец содержит группу или семейство элементов. Группа содержит элементы, которые имеют схожие физические или химические свойства.
Зоны периодической таблицы
Таблицу Менделеева можно разделить на разделы.
Один раздел состоит из первых двух групп, Группы 1 и 2, и элементов в Группах 3-18. Это репрезентативные элементы. К ним относятся металлы, металлоиды и неметаллы.
Металлы
Примеры: железо, олово, натрий и плутоний.
- обычно твердый при комнатной температуре (за исключением ртути)
- высокий блеск (блестящий)
- металлический вид
- хорошие проводники тепла и электричества
- пластичный (можно сгибать и растирать на тонкие листы)
- пластичный (может быть вытянут в проволоку)
- разъедать или окисляться на воздухе и в морской воде
- обычно плотный (исключения включают литий, калий и натрий)
- может иметь очень высокую температуру плавления
- легко терять электроны
Металлоиды
Примеры: бор, кремний и мышьяк.
- тусклый или блестящий
- обычно проводят тепло и электричество, но не так хорошо, как металлы
- часто делают хорошие полупроводники
- часто существуют в нескольких формах
- часто пластичный
- часто податливый
- может приобретать или терять электроны в реакциях
Неметаллы
Примеры: кислород, хлор и аргон.
- тусклый вид
- обычно хрупкий
- плохие проводники тепла и электричества
- обычно менее плотный по сравнению с металлами
- обычно низкая температура плавления твердых тел по сравнению с металлами
- имеют тенденцию получать электроны в химических реакциях
Группы 1 и 2
- Группа 1 - Щелочные металлы. Примеры: натрий, литий и калий.
- Группа 2 - Щелочноземельные металлы Примеры: бериллий, магний, кальций, барий и радий. Каждый щелочноземельный металл плотнее и тверже и имеет более высокую температуру плавления, чем щелочной металл в тот же период. Щелочноземельные металлы реакционноспособны, но не так реакционны, как щелочные металлы.
Группы с 13 по 18
Группа 13 - Семья Борон
- Примеры: бор (B), алюминий (Al), галлий (Ga), индий (In) и таллий (Tl).
- У них есть три валентных электрона.
Группа 14 - Семья углерода
- Примеры: углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb).
- Все они имеют четыре валентных электрона.
Группа 15 - Семья азота
- Примеры: азот (N), фосфор (P), мышьяк (As), сурьма (Sb) и висмут (Bi).
- Все эти элементы имеют пять валентных электронов.
- Азот и фосфор - неметаллы.
Группа 16 - Кислородная семья
- Примеры: кислород (O), сера (S), селен (Se), теллур (Te) и радиоактивный полоний (Po).
- В этой группе шесть валентных электронов.
- Они также известны как халькогены.
Группа 17 - Галогены
- Примеры: фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At).
- У них семь валентных электронов.
- Эта группа - первая, полностью состоящая из неметаллов.
- Галогены обладают высокой реакционной способностью и, как таковые, в достаточных количествах могут быть вредными или смертельными для биологических организмов.
- Символ X часто используется в общем для обозначения любого галогена.
- Название «галоген» означает «солеобразователь». Когда галогены реагируют с металлами, они образуют широкий спектр солей, включая кальций, фторид, хлорид натрия (поваренная соль), бромид серебра и иодид калия.
Группа 18 - Благородные газы
- Есть шесть благородных газов - гелий, неон, аргон, криптон, ксенон и радон.
- Все они газы и находятся в воздухе. Они составляют около 0,96% атмосферы.
- Все они одноатомные, то есть каждая молекула представляет собой отдельный атом.
- Они почти никогда не вступают в реакцию с другими элементами. Это потому, что у них есть полная внешняя электронная оболочка из 8 электронов.
- Благородные газы имеют очень низкие температуры кипения и плавления, что делает их полезными в качестве криогенных хладагентов.
Переходные металлы
- Элементы в группах 3–12 являются переходными.
- Все они металлы.
- Большинство переходных элементов встречается в рудах в сочетании с другими элементами.
- Некоторые переходные элементы, такие как золото и серебро, встречаются в чистом виде.
- Нити лампочек изготовлены из вольфрама (элемент 74), который имеет самую высокую температуру плавления среди всех металлов и не плавится при прохождении через него тока.
- Ртуть, которая имеет самую низкую температуру плавления из всех металлов, используется в термометрах и барометрах.
- Ртуть - единственный металл, который при комнатной температуре находится в жидком состоянии.
Железная триада
Три элемента в группе 4 - железо, кобальт и никель - обладают такими схожими свойствами, что известны как триада железа.
Платиновая группа
Рутений, родий, палладий, осмий, иридий и платина иногда называют платиновой группой, потому что они обладают схожими свойствами. Они нелегко сочетаются с другими элементами. В результате их можно использовать в качестве катализаторов.
Внутренние переходные элементы
Некоторые переходные элементы, называемые внутренними переходными элементами, размещаются под основной таблицей. Эти элементы называются серией лантанидов и актинидов, потому что одна серия следует за элементом лантан, элемент 57, а другая серия следует за актинием, элементом 89.
Лантаноиды - первая группа, от церия до лютеция, называется лантаноидами. Лантаноиды также называют редкоземельными элементами, потому что когда-то считалось, что их мало. Это мягкие металлы, которые можно разрезать ножом.
Актиниды - все актиниды радиоактивны. Торий, протактиний и уран - единственные актиниды, которые в настоящее время встречаются на Земле в естественных условиях. Все остальные актиниды - синтетические элементы. Синтетические элементы производятся в лабораториях и ядерных реакторах.
