Tabela periodike e elementeve kimike është një listë e elementeve të njohur. Në tabelë, elementët vendosen sipas renditjes së numrave të tyre atomik duke filluar me numrin më të ulët. Numri atomik i një elementi është i njëjtë me numrin e protoneve në atë atom të veçantë.
Dmitri Mendeleev merr meritën për hartimin e tabelës periodike moderne.
Çdo element ka një katror në tabelën periodike. Ka 3 informacione në çdo katror
- emri i elementit
- simboli i tij zyrtar kimik
- numri atomik të tij
Për shembull, sheshi për hekurin do të duket pak si ky:
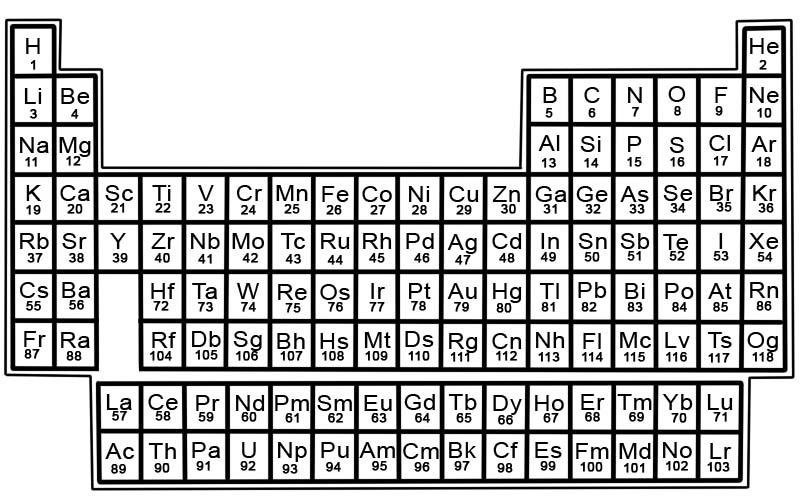
Elementet në tabelën periodike janë të renditura në rreshta dhe kolona.
- Rreshtat quhen perioda. Një periudhë është një rresht elementesh në tabelën periodike, vetitë e të cilave ndryshojnë gradualisht dhe në mënyrë të parashikueshme.
- Kolonat quhen grupe. Tabela periodike ka 18 kolona elementesh. Çdo kolonë përmban një grup, ose familje, elementësh. Një grup përmban elementë që kanë veti të ngjashme fizike ose kimike.
Zonat në tabelën periodike
Tabela periodike mund të ndahet në seksione.
Një seksion përbëhet nga dy grupet e para, Grupi 1 dhe 2, dhe elementët në Grupet 3-18. Këta janë elementët përfaqësues. Ato përfshijnë metale, metaloidë dhe jometale.
Metalet
Shembuj: hekuri, kallaji, natriumi dhe plutoniumi.
- zakonisht i ngurtë në temperaturën e dhomës (merkuri është një përjashtim)
- shkëlqim i lartë (me shkëlqim)
- pamje metalike
- përcjellës të mirë të nxehtësisë dhe energjisë elektrike
- i lakueshëm (mund të përkulet dhe të përplaset në fletë të holla)
- duktil (mund të tërhiqet në tel)
- gërryen ose oksidohen në ajër dhe ujin e detit
- zakonisht të dendura (përjashtimet përfshijnë litium, kalium dhe natrium)
- mund të ketë një pikë shkrirjeje shumë të lartë
- humbasin lehtësisht elektrone
Metaloidet
Shembuj: bor, silikon dhe arsenik.
- i shurdhër ose me shkëlqim
- zakonisht përçojnë nxehtësinë dhe energjinë elektrike, megjithëse jo aq mirë sa metalet
- shpesh bëjnë gjysmëpërçues të mirë
- shpesh ekzistojnë në disa forma
- shpesh duktile
- shpesh i lakueshëm
- mund të fitojë ose humbasë elektrone në reaksione
jometalet
Shembuj: oksigjen, klor dhe argon.
- pamje e shurdhër
- zakonisht i brishtë
- përçues të dobët të nxehtësisë dhe energjisë elektrike
- zakonisht më pak të dendura, krahasuar me metalet
- zakonisht pika e ulët e shkrirjes së lëndëve të ngurta, krahasuar me metalet
- priren të fitojnë elektrone në reaksionet kimike
Grupet 1 dhe 2
- Grupi 1 - Metalet alkaline. Shembuj: natriumi, litiumi dhe kaliumi.
- Grupi 2 - Metalet alkaline të tokës Shembuj: berilium, magnez, kalcium, barium dhe radium. Çdo metal alkaline tokësor është më i dendur dhe më i fortë dhe ka një pikë shkrirjeje më të lartë se metali alkali në të njëjtën periudhë. Metalet e tokës alkaline janë reaktive, por jo aq reaktive sa metalet alkaline.
Grupet 13 deri 18
Grupi 13 – Familja Boron
- Shembuj: bor (B), alumin (Al), galium (Ga), indium (In) dhe talium (Tl).
- Ata kanë tre elektrone valente.
Grupi 14 – Familja e karbonit
- Shembuj: karboni (C), silic (Si), germanium (Ge), kallaj (Sn) dhe plumb (Pb).
- Të gjithë kanë katër elektrone valente.
Grupi 15 – Familja e azotit
- Shembuj: azoti (N), fosfori (P), arseniku (As), antimoni (Sb) dhe bismut (Bi).
- Të gjithë këta elementë kanë pesë elektrone valente.
- Azoti dhe fosfori janë jometale.
Grupi 16 – Familja e oksigjenit
- Shembuj: oksigjen (O), squfur (S), selen (Se), teluri (Te) dhe polonium radioaktiv (Po).
- Ky grup ka gjashtë elektrone valente
- Këto njihen edhe si kalkogjenët.
Grupi 17 – Halogjenet
- Shembuj: fluor (F), klor (Cl), brom (Br), jod (I) dhe astatinë (At).
- Ata kanë shtatë elektrone valente.
- Ky grup është i pari që përbëhet nga tërësisht jometale.
- Halogjenët janë shumë reaktivë dhe si të tillë mund të jenë të dëmshëm ose vdekjeprurës për organizmat biologjikë në sasi të mjaftueshme.
- Simboli X shpesh përdoret përgjithësisht për t'iu referuar çdo halogjeni.
- Emri "halogjen" do të thotë "kripë-prodhues". Kur halogjenet reagojnë me metalet, ato prodhojnë një gamë të gjerë kripërash, duke përfshirë kalciumin, fluorin, klorurin e natriumit (kripa e tryezës), bromin argjendi dhe jodur kaliumi.
Grupi 18 – Gazet fisnike
- Ekzistojnë gjashtë gazra fisnikë - heliumi, neoni, argoni, kriptoni, ksenoni dhe radoni.
- Janë të gjitha gazra dhe gjenden në ajër. Ato përbëjnë rreth 0.96% të atmosferës.
- Të gjithë ata janë monoatomikë, që do të thotë se çdo molekulë është një atom i vetëm.
- Ata pothuajse kurrë nuk reagojnë me elementë të tjerë. Kjo është për shkak se ata kanë një shtresë të jashtme elektronike plot 8 elektrone.
- Gazet fisnike kanë pika shumë të ulëta vlimi dhe shkrirjeje, gjë që i bën ata të dobishëm si ftohës kriogjenë.
Metalet e tranzicionit
- Elementet në Grupet 3-12 janë elemente kalimtare.
- Ato janë të gjitha metale.
- Shumica e elementeve të tranzicionit gjenden të kombinuara me elementë të tjerë në xehe.
- Disa elemente tranzicioni si ari dhe argjendi gjenden si elementë të pastër.
- Fijet e llambave janë prej tungsteni (elementi 74) i cili ka pikën më të lartë të shkrirjes nga çdo metal dhe nuk do të shkrihet kur një rrymë kalon nëpër të.
- Mërkuri, i cili ka pikën më të ulët të shkrirjes nga çdo metal, përdoret në termometra dhe barometra.
- Mërkuri është i vetmi metal që është i lëngshëm në temperaturën e dhomës.
Treshe hekuri
Tre elementë në grupin 4 - hekuri, kobalti dhe nikeli - kanë veti kaq të ngjashme sa që njihen si treshe e hekurit.
Grupi i platinit
Ruteniumi, rodiumi, paladiumi, osmiumi, iridiumi dhe platini nganjëherë quhen grupi i platinit sepse kanë veti të ngjashme. Ato nuk kombinohen lehtë me elementë të tjerë. Si rezultat, ato mund të përdoren si katalizatorë.
Elementet e tranzicionit të brendshëm
Disa elemente tranzicioni, të quajtur elementë të tranzicionit të brendshëm, vendosen poshtë tabelës kryesore. Këta elementë quhen seri lantanide dhe aktinide sepse njëra seri ndjek elementin lantan, elementi 57, dhe seria tjetër pas aktiniumit, elementi 89.
Lantanidet - Seria e parë, nga cerium në lutetium, quhet lantanide. Lantanidet quhen gjithashtu toka e rrallë sepse në një kohë mendohej se ishin të pakta. Janë metale të buta që mund të priten me thikë.
Aktinidet - Të gjitha aktinidet janë radioaktive. Toriumi, protaktiniumi dhe uraniumi janë të vetmet aktinide që tani gjenden natyrshëm në Tokë. Të gjitha aktinidet e tjera janë elemente sintetike. Elementet sintetike bëhen në laboratorë dhe reaktorë bërthamorë.
