Det periodiska systemet för de kemiska grundämnena är en lista över kända grundämnen. I tabellen är grundämnena placerade i ordningsföljd av deras atomnummer som börjar med det lägsta numret. Atomnumret för ett grundämne är detsamma som antalet protoner i den specifika atomen.
Dmitri Mendeleev får äran för att ha designat det moderna periodiska systemet.
Varje element har en kvadrat i det periodiska systemet. Det finns 3 uppgifter i varje ruta
- namnet på elementet
- dess officiella kemiska symbol
- dess atomnummer
Till exempel kommer kvadraten för järn att se ut ungefär så här:
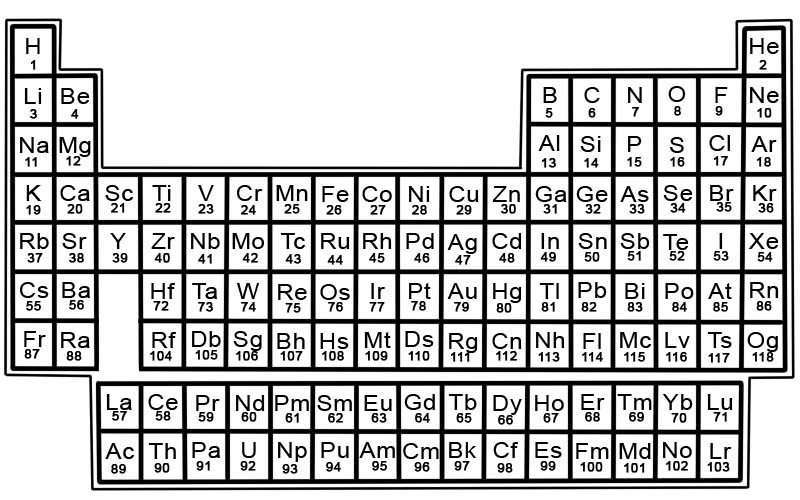
Element i det periodiska systemet är ordnade i rader och kolumner.
- Rader kallas perioder. En period är en rad av element i det periodiska systemet vars egenskaper ändras gradvis och förutsägbart.
- Kolumner kallas grupper. Det periodiska systemet har 18 kolumner med element. Varje kolumn innehåller en grupp, eller familj, av element. En grupp innehåller grundämnen som har liknande fysikaliska eller kemiska egenskaper.
Zoner på det periodiska systemet
Det periodiska systemet kan delas in i sektioner.
En sektion består av de två första grupperna, grupp 1 och 2, och elementen i grupp 3-18. Dessa är de representativa elementen. De inkluderar metaller, metalloider och icke-metaller.
Metaller
Exempel: järn, tenn, natrium och plutonium.
- vanligtvis fast vid rumstemperatur (kvicksilver är ett undantag)
- hög lyster (glänsande)
- metalliskt utseende
- bra ledare av värme och elektricitet
- formbar (kan böjas och slås till tunna ark)
- duktil (kan dras in i tråd)
- korroderar eller oxiderar i luft och havsvatten
- vanligtvis tät (undantag inkluderar litium, kalium och natrium)
- kan ha en mycket hög smältpunkt
- förlorar lätt elektroner
Metalloider
Exempel: bor, kisel och arsenik.
- matt eller glänsande
- leder vanligtvis värme och elektricitet, men inte lika bra som metaller
- gör ofta bra halvledare
- finns ofta i flera former
- ofta duktil
- ofta formbar
- kan få eller förlora elektroner i reaktioner
Icke-metaller
Exempel: syre, klor och argon.
- trist utseende
- vanligtvis sprött
- dåliga ledare av värme och el
- vanligtvis mindre tät, jämfört med metaller
- vanligtvis låg smältpunkt för fasta ämnen, jämfört med metaller
- tenderar att få elektroner i kemiska reaktioner
Grupp 1 och 2
- Grupp 1 - Alkalimetaller. Exempel: natrium, litium och kalium.
- Grupp 2 - Alkaliska jordartsmetaller Exempel: beryllium, magnesium, kalcium, barium och radium. Varje jordalkalimetall är tätare och hårdare och har en högre smältpunkt än alkalimetallen under samma period. Alkaliska jordartsmetaller är reaktiva men inte lika reaktiva som alkalimetaller.
Grupp 13 till 18
Grupp 13 – Boron familj
- Exempel: bor (B), aluminium (Al), gallium (Ga), indium (In) och tallium (Tl).
- De har tre valenselektroner.
Grupp 14 – Kolfamilj
- Exempel: kol (C), kisel (Si), germanium (Ge), tenn (Sn) och bly (Pb).
- De har alla fyra valenselektroner.
Grupp 15 – Kvävefamilj
- Exempel: kväve (N), fosfor (P), arsenik (As), antimon (Sb) och vismut (Bi).
- Dessa grundämnen har alla fem valenselektroner.
- Kväve och fosfor är icke-metaller.
Grupp 16 – Syrefamiljen
- Exempel: syre (O), svavel (S), selen (Se), tellur (Te) och radioaktivt polonium (Po).
- Denna grupp har sex valenselektroner
- Dessa är också kända som kalkogenerna.
Grupp 17 – Halogener
- Exempel: fluor (F), klor (Cl), brom (Br), jod (I) och astatin (At).
- De har sju valenselektroner.
- Denna grupp är den första som består av helt icke-metaller.
- Halogener är mycket reaktiva och kan som sådana vara skadliga eller dödliga för biologiska organismer i tillräckliga mängder.
- Symbolen X används ofta generiskt för att referera till vilken halogen som helst.
- Namnet "halogen" betyder "saltproducerande". När halogener reagerar med metaller producerar de ett brett spektrum av salter, inklusive kalcium, fluorid, natriumklorid (bordssalt), silverbromid och kaliumjodid.
Grupp 18 – Ädelgaser
- Det finns sex ädelgaser – helium, neon, argon, krypton, xenon och radon.
- De är alla gaser och finns i luften. De utgör cirka 0,96 % av atmosfären.
- Alla av dem är monoatomiska, vilket betyder att varje molekyl är en enda atom.
- De reagerar nästan aldrig med andra element. Detta beror på att de har hela 8 elektroners yttre elektronskal.
- Ädelgaser har mycket låga kok- och smältpunkter, vilket gör dem användbara som kryogena köldmedier.
Övergångsmetaller
- Elementen i grupp 3-12 är övergångselement.
- De är alla metaller.
- De flesta övergångselement finns i kombination med andra element i malmer.
- Några få övergångselement som guld och silver återfinns som rena element.
- Glödlampornas glödtrådar är gjorda av volfram (element 74) som har den högsta smältpunkten av någon metall och kommer inte att smälta när en ström passerar genom den.
- Kvicksilver, som har den lägsta smältpunkten av någon metall, används i termometrar och barometrar.
- Kvicksilver är den enda metall som är en vätska vid rumstemperatur.
Järntriad
Tre grundämnen i grupp 4 – järn, kobolt och nickel – har så liknande egenskaper att de kallas järntriaden.
Platinagruppen
Rutenium, rodium, palladium, osmium, iridium och platina kallas ibland platinagruppen eftersom de har liknande egenskaper. De kombineras inte lätt med andra element. Som ett resultat kan de användas som katalysatorer.
Inre övergångselement
Vissa övergångselement, som kallas de inre övergångselementen, är placerade under huvudtabellen. Dessa grundämnen kallas lantanid- och aktinidserien eftersom en serie följer grundämnet lantan, element 57, och den andra serien följer aktinium, element 89.
Lantanider - Den första serien, från cerium till lutetium, kallas lantanider. Lantaniderna kallas också för den sällsynta jordarten eftersom de en gång ansågs vara knappa. De är mjuka metaller som kan skäras med en kniv.
Aktinider - Alla aktinider är radioaktiva. Torium, protactinium och uran är de enda aktinider som nu finns naturligt på jorden. Alla andra aktinider är syntetiska grundämnen. Syntetiska grundämnen tillverkas i laboratorier och kärnreaktorer.
