ตารางธาตุขององค์ประกอบทางเคมีคือรายการของธาตุที่ทราบ ในตาราง ธาตุต่างๆ จะเรียงตามลำดับเลขอะตอมโดยเริ่มจากเลขต่ำสุด เลขอะตอมของธาตุจะเท่ากับจำนวนโปรตอนในอะตอมนั้น ๆ
Dmitri Mendeleev ได้รับเครดิตในการออกแบบตารางธาตุสมัยใหม่
แต่ละองค์ประกอบมีสี่เหลี่ยมจัตุรัสในตารางธาตุ มีข้อมูล 3 ชิ้นในแต่ละช่อง
- ชื่อขององค์ประกอบ
- สัญลักษณ์ทางเคมีอย่างเป็นทางการ
- เลขอะตอมของมัน
ตัวอย่างเช่น สี่เหลี่ยมสำหรับเหล็กจะมีลักษณะดังนี้:
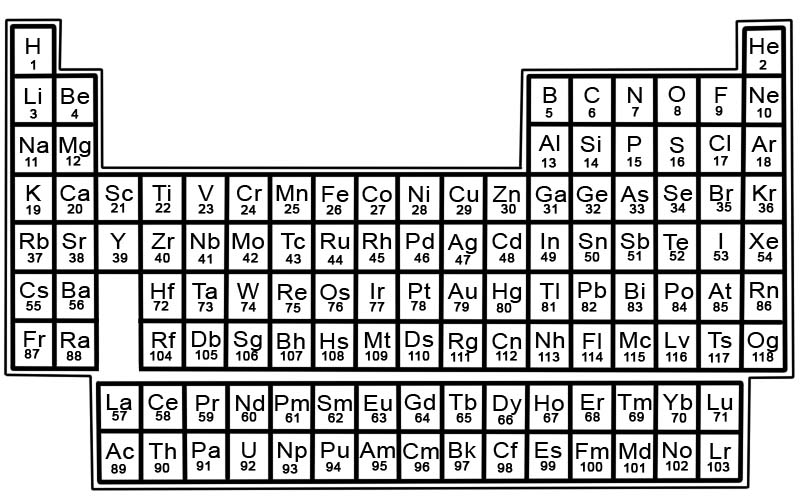
องค์ประกอบในตารางธาตุจัดเรียงเป็นแถวและคอลัมน์
- แถว เรียกว่าจุด คาบคือแถวขององค์ประกอบในตารางธาตุซึ่งคุณสมบัติจะค่อยๆ เปลี่ยนแปลงและคาดการณ์ได้
- คอลัมน์ เรียกว่ากลุ่ม ตารางธาตุมีองค์ประกอบ 18 คอลัมน์ แต่ละคอลัมน์ประกอบด้วยกลุ่มหรือกลุ่มขององค์ประกอบ กลุ่มประกอบด้วยองค์ประกอบที่มีคุณสมบัติทางกายภาพหรือทางเคมีที่คล้ายคลึงกัน
โซนในตารางธาตุ
ตารางธาตุสามารถแบ่งออกเป็นส่วนต่างๆ
ส่วนหนึ่งประกอบด้วยสองกลุ่มแรก กลุ่ม 1 และ 2 และองค์ประกอบในกลุ่ม 3-18 เหล่านี้เป็นองค์ประกอบที่เป็นตัวแทน ได้แก่ โลหะ เมทัลลอยด์ และอโลหะ
โลหะ
ตัวอย่าง: เหล็ก ดีบุก โซเดียม และพลูโทเนียม
- มักจะแข็งตัวที่อุณหภูมิห้อง (ยกเว้นปรอท)
- มีความมันวาวสูง (เป็นมันเงา)
- ลักษณะโลหะ
- ตัวนำความร้อนและไฟฟ้าที่ดี
- อ่อนได้ (สามารถงอและทุบเป็นแผ่นบางได้)
- เหนียว (สามารถดึงเป็นเส้นลวดได้)
- กัดกร่อนหรือออกซิไดซ์ในอากาศและน้ำทะเล
- มักหนาแน่น (ยกเว้นลิเธียม โพแทสเซียม และโซเดียม)
- อาจมีจุดหลอมเหลวสูงมาก
- สูญเสียอิเล็กตรอนอย่างง่ายดาย
เมทัลลอยด์
ตัวอย่าง: โบรอน ซิลิกอน และสารหนู
- หมองคล้ำหรือเป็นมันเงา
- มักจะนำความร้อนและไฟฟ้า แม้ว่าจะไม่ใช่เช่นเดียวกับโลหะก็ตาม
- มักจะผลิตสารกึ่งตัวนำที่ดี
- มักมีอยู่หลายรูปแบบ
- มักจะเหนียวเหนอะหนะ
- มักจะอ่อนไหว
- อาจได้รับหรือสูญเสียอิเล็กตรอนในปฏิกิริยา
อโลหะ
ตัวอย่าง: ออกซิเจน คลอรีน และอาร์กอน
- หน้าตาหมองคล้ำ
- มักจะเปราะ
- ตัวนำความร้อนและไฟฟ้าไม่ดี
- มักมีความหนาแน่นน้อยกว่าเมื่อเทียบกับโลหะ
- มักจะจุดหลอมเหลวของของแข็งต่ำเมื่อเทียบกับโลหะ
- มีแนวโน้มที่จะได้รับอิเล็กตรอนในปฏิกิริยาเคมี
กลุ่มที่ 1 และ 2
- กลุ่มที่ 1 - โลหะอัลคาไล ตัวอย่าง: โซเดียม ลิเธียม และโพแทสเซียม
- กลุ่มที่ 2 - โลหะอัลคาไลน์เอิร์ท ตัวอย่าง: เบริลเลียม แมกนีเซียม แคลเซียม แบเรียม และเรเดียม โลหะอัลคาไลน์เอิร์ ธ แต่ละตัวมีความหนาแน่นและแข็งกว่าและมีจุดหลอมเหลวสูงกว่าโลหะอัลคาไลในช่วงเวลาเดียวกัน โลหะอัลคาไลน์เอิร์ ธ มีปฏิกิริยา แต่ไม่ทำปฏิกิริยาเหมือนโลหะอัลคาไล
กลุ่ม 13 ถึง 18
กลุ่มที่ 13 – ตระกูลโบรอน
- ตัวอย่าง: โบรอน (B), อะลูมิเนียม (Al), แกลเลียม (Ga), อินเดียม (In) และแทลเลียม (Tl)
- พวกมันมีเวเลนซ์อิเล็กตรอนสามตัว
กลุ่มที่ 14 – ตระกูลคาร์บอน
- ตัวอย่าง: คาร์บอน (C), ซิลิกอน (Si), เจอร์เมเนียม (Ge), ดีบุก (Sn) และตะกั่ว (Pb)
- พวกมันทั้งหมดมีเวเลนซ์อิเล็กตรอนสี่ตัว
กลุ่มที่ 15 – ตระกูลไนโตรเจน
- ตัวอย่าง: ไนโตรเจน (N) ฟอสฟอรัส (P) สารหนู (As) พลวง (Sb) และบิสมัท (Bi)
- ธาตุเหล่านี้ล้วนมีเวเลนซ์อิเล็กตรอนห้าตัว
- ไนโตรเจนและฟอสฟอรัสเป็นอโลหะ
กลุ่มที่ 16 – ตระกูลออกซิเจน
- ตัวอย่าง: ออกซิเจน (O) กำมะถัน (S) ซีลีเนียม (Se) เทลลูเรียม (เท) และพอโลเนียมกัมมันตภาพรังสี (Po)
- กลุ่มนี้มีเวเลนซ์อิเล็กตรอน 6 ตัว
- สิ่งเหล่านี้เรียกว่า chalcogens
กลุ่มที่ 17 – ฮาโลเจน
- ตัวอย่าง: ฟลูออรีน (F), คลอรีน (Cl), โบรมีน (Br), ไอโอดีน (I) และแอสทาทีน (At)
- พวกเขามีเวเลนซ์อิเล็กตรอนเจ็ดตัว
- กลุ่มนี้เป็นกลุ่มแรกที่ประกอบด้วยอโลหะทั้งหมด
- ฮาโลเจนมีปฏิกิริยาสูง และอาจเป็นอันตรายต่อสิ่งมีชีวิตทางชีวภาพได้ในปริมาณที่เพียงพอ
- สัญลักษณ์ X มักใช้โดยทั่วไปเพื่ออ้างถึงฮาโลเจนใดๆ
- ชื่อ "ฮาโลเจน" หมายถึง "การผลิตเกลือ" เมื่อฮาโลเจนทำปฏิกิริยากับโลหะ จะผลิตเกลือหลายชนิด รวมทั้งแคลเซียม ฟลูออไรด์ โซเดียมคลอไรด์ (เกลือแกง) ซิลเวอร์โบรไมด์ และโพแทสเซียมไอโอไดด์
กลุ่มที่ 18 – ก๊าซมีตระกูล
- มีก๊าซมีตระกูลอยู่ 6 ชนิด ได้แก่ ฮีเลียม นีออน อาร์กอน คริปทอน ซีนอน และเรดอน
- ล้วนเป็นก๊าซและพบได้ในอากาศ พวกมันประกอบขึ้นประมาณ 0.96% ของบรรยากาศ
- ทั้งหมดเป็นอะตอมเดี่ยว ซึ่งหมายความว่าแต่ละโมเลกุลเป็นอะตอมเดี่ยว
- แทบไม่เคยทำปฏิกิริยากับองค์ประกอบอื่นเลย เนื่องจากพวกมันมีเปลือกอิเล็กตรอนชั้นนอก 8 อิเล็กตรอนเต็ม
- ก๊าซมีตระกูลมีจุดเดือดและจุดหลอมเหลวต่ำมาก ซึ่งทำให้มีประโยชน์ในฐานะสารทำความเย็นที่อุณหภูมิต่ำ
โลหะทรานซิชัน
- องค์ประกอบในกลุ่ม 3-12 เป็นองค์ประกอบการเปลี่ยนแปลง
- พวกมันเป็นโลหะทั้งหมด
- ธาตุทรานซิชันส่วนใหญ่จะพบรวมกับธาตุอื่นๆ ในแร่
- ธาตุทรานซิชันบางอย่าง เช่น ทองและเงิน ถูกพบเป็นองค์ประกอบที่บริสุทธิ์
- ไส้หลอดของหลอดไฟทำจากทังสเตน (องค์ประกอบ 74) ซึ่งมีจุดหลอมเหลวสูงสุดของโลหะใดๆ และจะไม่ละลายเมื่อกระแสไหลผ่าน
- ปรอทซึ่งมีจุดหลอมเหลวต่ำสุดของโลหะใดๆ ถูกใช้ในเทอร์โมมิเตอร์และบารอมิเตอร์
- ปรอทเป็นโลหะชนิดเดียวที่เป็นของเหลวที่อุณหภูมิห้อง
ไตรเหล็ก
ธาตุสามชนิดในกลุ่มที่ 4 ได้แก่ เหล็ก โคบอลต์ และนิกเกิล มีคุณสมบัติคล้ายคลึงกันจนเรียกว่าธาตุเหล็ก
แพลตตินั่ม กรุ๊ป
รูทีเนียม โรเดียม แพลเลเดียม ออสเมียม อิริเดียม และแพลตตินั่ม บางครั้งเรียกว่ากลุ่มแพลตตินั่ม เพราะมีคุณสมบัติใกล้เคียงกัน พวกมันไม่สามารถรวมเข้ากับองค์ประกอบอื่นได้ง่าย เป็นผลให้สามารถใช้เป็นตัวเร่งปฏิกิริยาได้
องค์ประกอบการเปลี่ยนแปลงภายใน
องค์ประกอบการเปลี่ยนแปลงบางอย่าง เรียกว่าองค์ประกอบการเปลี่ยนแปลงภายใน ถูกวางไว้ใต้ตารางหลัก องค์ประกอบเหล่านี้เรียกว่าชุดแลนทาไนด์และแอกทิไนด์เนื่องจากชุดหนึ่งอยู่หลังธาตุแลนทานัม องค์ประกอบ 57 และชุดอื่นๆ ตามหลังแอกทิเนียมธาตุ 89
แลนทาไนด์ - ชุดแรกจากซีเรียมถึงลูทีเซียมเรียกว่าแลนทาไนด์ แลนทาไนด์เรียกอีกอย่างว่าแรร์เอิร์ธเพราะครั้งหนึ่งเคยคิดว่าหายาก เป็นโลหะอ่อนที่สามารถตัดด้วยมีดได้
actinides - แอกทิไนด์ทั้งหมดที่มีสารกัมมันตรังสี ทอเรียม โพรแทกทิเนียม และยูเรเนียมเป็นแอกทิไนด์เพียงชนิดเดียวที่พบตามธรรมชาติบนโลก แอคติไนด์อื่นๆ ทั้งหมดเป็นองค์ประกอบสังเคราะห์ องค์ประกอบสังเคราะห์ถูกสร้างขึ้นในห้องปฏิบัติการและเครื่องปฏิกรณ์นิวเคลียร์
