Ang periodic table ng mga elemento ng kemikal ay isang listahan ng mga kilalang elemento. Sa talahanayan, ang mga elemento ay inilalagay sa pagkakasunud-sunod ng kanilang mga atomic number na nagsisimula sa pinakamababang bilang. Ang atomic number ng isang elemento ay kapareho ng bilang ng mga proton sa partikular na atom na iyon.
Nakuha ni Dmitri Mendeleev ang kredito para sa pagdidisenyo ng modernong periodic table.
Ang bawat elemento ay may parisukat sa periodic table. Mayroong 3 piraso ng impormasyon sa bawat parisukat
- ang pangalan ng elemento
- opisyal na simbolo ng kemikal nito
- atomic number nito
Halimbawa, ang parisukat para sa bakal ay magmumukhang ganito:
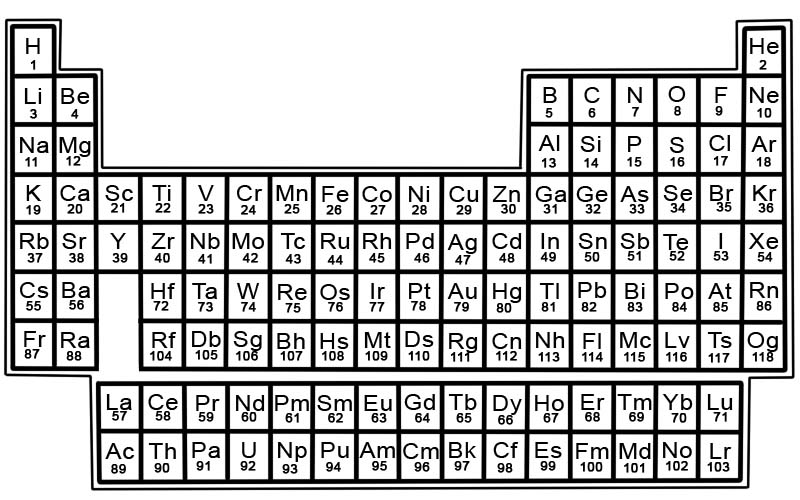
Ang mga elemento sa periodic table ay nakaayos sa mga row at column.
- Ang mga hilera ay tinatawag na mga tuldok. Ang period ay isang hilera ng mga elemento sa periodic table na ang mga katangian ay unti-unting nagbabago at predictably.
- Ang mga hanay ay tinatawag na mga pangkat. Ang periodic table ay may 18 column ng mga elemento. Ang bawat column ay naglalaman ng grupo, o pamilya, ng mga elemento. Ang isang pangkat ay naglalaman ng mga elemento na may magkatulad na katangiang pisikal o kemikal.
Mga zone sa periodic table
Ang periodic table ay maaaring hatiin sa mga seksyon.
Ang isang seksyon ay binubuo ng unang dalawang pangkat, Pangkat 1 at 2, at ang mga elemento sa Pangkat 3-18. Ito ang mga elementong kinatawan. Kabilang dito ang mga metal, metalloid, at nonmetals.
Mga metal
Mga halimbawa: bakal, lata, sodium, at plutonium.
- karaniwang solid sa temperatura ng silid (mercury ay isang pagbubukod)
- mataas na ningning (makintab)
- hitsura ng metal
- magandang konduktor ng init at kuryente
- malleable (maaaring baluktot at puksain sa manipis na mga piraso)
- ductile (maaaring iguhit sa wire)
- kinakain o na-oxidize sa hangin at tubig-dagat
- karaniwang siksik (kasama sa mga eksepsiyon ang lithium, potassium, at sodium)
- maaaring magkaroon ng napakataas na punto ng pagkatunaw
- madaling mawala ang mga electron
Mga Metalloid
Mga halimbawa: boron, silicon, at arsenic.
- mapurol o makintab
- kadalasang nagsasagawa ng init at kuryente, bagaman hindi tulad ng mga metal
- madalas gumawa ng magandang semiconductors
- madalas na umiiral sa iba't ibang anyo
- madalas ductile
- madalas malambot
- maaaring makakuha o mawalan ng mga electron sa mga reaksyon
Mga hindi metal
Mga halimbawa: oxygen, chlorine, at argon.
- mapurol na hitsura
- kadalasang malutong
- mahinang konduktor ng init at kuryente
- karaniwang hindi gaanong siksik, kumpara sa mga metal
- karaniwang mababa ang temperatura ng pagkatunaw ng mga solid, kumpara sa mga metal
- may posibilidad na makakuha ng mga electron sa mga reaksiyong kemikal
Pangkat 1 at 2
- Pangkat 1 - Mga metal na alkali. Mga halimbawa: sodium, lithium, at potassium.
- Pangkat 2 - Alkaline earth metals Mga halimbawa: beryllium, magnesium, calcium, barium, at radium. Ang bawat alkaline earth metal ay mas siksik at mas matigas at may mas mataas na punto ng pagkatunaw kaysa sa alkali metal sa parehong panahon. Ang mga alkaline earth metal ay reaktibo ngunit hindi kasing reaktibo ng mga alkali metal.
Pangkat 13 hanggang 18
Pangkat 13 – Pamilya Boron
- Mga halimbawa: boron (B), aluminum (Al), gallium (Ga), indium (In), at thallium (Tl).
- Mayroon silang tatlong valence electron.
Pangkat 14 – Carbon family
- Mga halimbawa: carbon (C), silicon (Si), germanium (Ge), lata (Sn), at lead (Pb).
- Lahat sila ay may apat na valence electron.
Pangkat 15 – Pamilya ng nitrogen
- Mga halimbawa: nitrogen (N), phosphorus (P), arsenic (As), antimony (Sb), at bismuth (Bi).
- Ang mga elementong ito ay mayroong limang valence electron.
- Ang Nitrogen at Phosphorous ay hindi metal.
Pangkat 16 – Pamilya ng oxygen
- Mga halimbawa: oxygen (O), sulfur (S), selenium (Se), tellurium (Te), at radioactive polonium (Po).
- Ang pangkat na ito ay may anim na valence electron
- Ang mga ito ay kilala rin bilang mga chalcogens.
Pangkat 17 – Halogens
- Mga halimbawa: fluorine (F), chlorine (Cl), bromine (Br), iodine (I), at astatine (At).
- Mayroon silang pitong valence electron.
- Ang pangkat na ito ang unang binubuo ng ganap na hindi metal.
- Ang mga halogens ay lubos na reaktibo, at dahil dito ay maaaring makapinsala o nakamamatay sa mga biyolohikal na organismo sa sapat na dami.
- Ang simbolo X ay kadalasang ginagamit sa pangkalahatan upang sumangguni sa anumang halogen.
- Ang pangalang "halogen" ay nangangahulugang "salt-producing". Kapag ang mga halogens ay tumutugon sa mga metal, gumagawa sila ng malawak na hanay ng mga asing-gamot, kabilang ang calcium, fluoride, sodium chloride (table salt), silver bromide at potassium iodide.
Pangkat 18 – Noble gases
- Mayroong anim na noble gas - helium, neon, argon, krypton, xenon, at radon.
- Lahat sila ay mga gas at matatagpuan sa hangin. Binubuo nila ang humigit-kumulang 0.96% ng atmospera.
- Ang lahat ng mga ito ay monoatomic, ibig sabihin ang bawat molekula ay isang solong atom.
- Halos hindi sila tumugon sa iba pang mga elemento. Ito ay dahil mayroon silang buong 8 electron outer electron shell.
- Ang mga noble gas ay may napakababang kumukulo at natutunaw na mga punto, na ginagawa itong kapaki-pakinabang bilang mga cryogenic na nagpapalamig.
Mga metal na transisyon
- Ang mga elemento sa Pangkat 3-12 ay mga elemento ng paglipat.
- Lahat sila ay mga metal.
- Karamihan sa mga elemento ng paglipat ay matatagpuan na pinagsama sa iba pang mga elemento sa ores.
- Ang ilang mga elemento ng paglipat tulad ng ginto at pilak ay matatagpuan bilang mga purong elemento.
- Ang mga filament ng mga bombilya ay gawa sa tungsten (elemento 74) na may pinakamataas na punto ng pagkatunaw ng anumang metal at hindi matutunaw kapag may dumaan dito.
- Ang Mercury, na may pinakamababang punto ng pagkatunaw ng anumang metal, ay ginagamit sa mga thermometer at barometer.
- Ang mercury ay ang tanging metal na likido sa temperatura ng silid.
bakal na triad
Tatlong elemento sa pangkat 4 - iron, cobalt, at nickel - ay may katulad na mga katangian na kilala sila bilang iron triad.
Grupo ng platinum
Ang Ruthenium, rhodium, palladium, osmium, iridium, at platinum ay tinatawag minsan na pangkat ng platinum dahil mayroon silang mga katulad na katangian. Hindi sila madaling pinagsama sa iba pang mga elemento. Bilang isang resulta, maaari silang magamit bilang mga catalyst.
Mga elemento ng panloob na paglipat
Ang ilang mga elemento ng paglipat, na tinatawag na mga elemento ng panloob na paglipat, ay inilalagay sa ibaba ng pangunahing talahanayan. Ang mga elementong ito ay tinatawag na lanthanide at actinide series dahil ang isang serye ay sumusunod sa elementong lanthanum, elemento 57, at ang isa pang serye ay sumusunod sa actinium, elemento 89.
Lanthanides - Ang unang serye, mula sa cerium hanggang lutetium, ay tinatawag na lanthanides. Ang mga lanthanides ay tinatawag ding rare earth dahil minsan ay inakala nilang kakaunti. Ang mga ito ay malambot na metal na maaaring putulin gamit ang isang kutsilyo.
Actinides - Ang lahat ng actinides ay radioactive. Ang Thorium, protactinium, at uranium ay ang tanging actinides na natural na matatagpuan ngayon sa Earth. Ang lahat ng iba pang actinides ay mga sintetikong elemento. Ang mga sintetikong elemento ay ginawa sa mga laboratoryo at nuclear reactor.
