Kimyasal elementlerin periyodik tablosu, bilinen elementlerin bir listesidir. Tabloda elementler atom numaralarına göre en küçük numaradan başlayarak sıralanmıştır. Bir elementin atom numarası, o atomdaki proton sayısı ile aynıdır.
Dmitri Mendeleev, modern periyodik tabloyu tasarlamak için övgü aldı.
Periyodik tabloda her elementin bir karesi vardır. Her karede 3 adet bilgi vardır.
- elementin adı
- resmi kimyasal sembolü
- atom numarası
Örneğin, demir için kare biraz şöyle görünecektir:
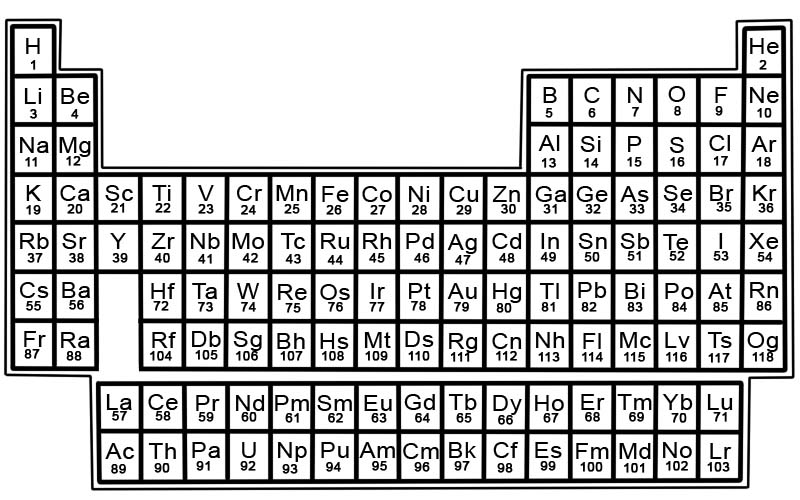
Periyodik tablodaki elementler satırlar ve sütunlar halinde düzenlenmiştir.
- Satırlara nokta denir. Periyot, özellikleri kademeli ve tahmin edilebilir şekilde değişen periyodik tablodaki bir dizi elementtir.
- Sütunlara grup adı verilir. Periyodik tabloda 18 element sütunu vardır. Her sütun bir öğe grubu veya ailesi içerir. Bir grup, benzer fiziksel veya kimyasal özelliklere sahip elementleri içerir.
Periyodik tablodaki bölgeler
Periyodik tablo bölümlere ayrılabilir.
Bir bölüm, ilk iki grup olan Grup 1 ve 2'den ve Grup 3-18'deki elementlerden oluşur. Bunlar temsili unsurlardır. Bunlar metalleri, metaloidleri ve ametalleri içerir.
metaller
Örnekler: demir, kalay, sodyum ve plütonyum.
- genellikle oda sıcaklığında katıdır (cıva bir istisnadır)
- yüksek parlaklık (parlak)
- metalik görünüm
- ısı ve elektriği iyi iletir
- dövülebilir (bükülebilir ve ince tabakalar halinde dövülebilir)
- sünek (tel haline getirilebilir)
- havada ve deniz suyunda paslanır veya oksitlenir
- genellikle yoğun (istisnalar arasında lityum, potasyum ve sodyum bulunur)
- çok yüksek bir erime noktasına sahip olabilir
- kolayca elektron kaybetmek
Metaloidler
Örnekler: bor, silikon ve arsenik.
- donuk veya parlak
- metaller kadar iyi olmasa da genellikle ısı ve elektriği iletirler
- genellikle iyi yarı iletkenler yapar
- genellikle birkaç biçimde bulunur
- genellikle sünek
- genellikle yumuşak
- reaksiyonlarda elektron alabilir veya kaybedebilir
ametaller
Örnekler: oksijen, klor ve argon.
- donuk görünüm
- genellikle kırılgan
- ısı ve elektriği iletmeyen zayıf iletkenler
- metallere kıyasla genellikle daha az yoğun
- metallere kıyasla katıların genellikle düşük erime noktası
- kimyasal reaksiyonlarda elektron kazanma eğilimindedir
Grup 1 ve 2
- Grup 1 - Alkali metaller. Örnekler: sodyum, lityum ve potasyum.
- Grup 2 - Alkali toprak metalleri Örnekler: berilyum, magnezyum, kalsiyum, baryum ve radyum. Her alkali toprak metali, aynı periyotta alkali metalden daha yoğun ve serttir ve daha yüksek bir erime noktasına sahiptir. Alkali toprak metalleri reaktiftir ancak alkali metaller kadar reaktif değildir.
Gruplar 13 - 18
Grup 13 – Bor ailesi
- Örnekler: bor (B), alüminyum (Al), galyum (Ga), indiyum (In) ve talyum (Tl).
- Üç değerlik elektronları vardır.
Grup 14 – Karbon ailesi
- Örnekler: karbon (C), silikon (Si), germanyum (Ge), kalay (Sn) ve kurşun (Pb).
- Hepsinin dört değerlik elektronu vardır.
Grup 15 – Azot ailesi
- Örnekler: nitrojen (N), fosfor (P), arsenik (As), antimon (Sb) ve bizmut (Bi).
- Bu elementlerin hepsinin beş değerlik elektronu vardır.
- Azot ve Fosfor metal değildir.
Grup 16 – Oksijen ailesi
- Örnekler: oksijen (O), kükürt (S), selenyum (Se), tellür (Te) ve radyoaktif polonyum (Po).
- Bu grubun altı değerlik elektronu vardır.
- Bunlar aynı zamanda kalkojenler olarak da bilinir.
Grup 17 – Halojenler
- Örnekler: flor (F), klor (Cl), brom (Br), iyot (I) ve astatin (At).
- Yedi değerlik elektronları vardır.
- Bu grup tamamen ametallerden oluşan ilk gruptur.
- Halojenler oldukça reaktiftir ve bu nedenle yeterli miktarlarda biyolojik organizmalar için zararlı veya öldürücü olabilir.
- X sembolü genellikle genel olarak herhangi bir halojeni ifade etmek için kullanılır.
- "Halojen" adı "tuz üreten" anlamına gelir. Halojenler metallerle reaksiyona girdiğinde, kalsiyum, florür, sodyum klorür (sofra tuzu), gümüş bromür ve potasyum iyodür dahil olmak üzere çok çeşitli tuzlar üretirler.
Grup 18 – Soy gazlar
- Altı soy gaz vardır - helyum, neon, argon, kripton, ksenon ve radon.
- Hepsi gazdır ve havada bulunurlar. Atmosferin yaklaşık %0,96'sını oluştururlar.
- Hepsi monoatomiktir, yani her molekül tek bir atomdur.
- Neredeyse hiçbir zaman diğer elementlerle reaksiyona girmezler. Bunun nedeni, tam 8 elektronlu bir dış elektron kabuğuna sahip olmalarıdır.
- Soy gazların çok düşük kaynama ve erime noktaları vardır, bu da onları kriyojenik soğutucu akışkanlar olarak kullanışlı kılar.
Geçiş metalleri
- Grup 3-12'deki öğeler geçiş öğeleridir.
- Hepsi metaldir.
- Çoğu geçiş elementi cevherlerde diğer elementlerle birleşmiş olarak bulunur.
- Altın ve gümüş gibi birkaç geçiş elementi saf element olarak bulunur.
- Ampullerin telleri, tüm metaller arasında en yüksek erime noktasına sahip olan ve içinden akım geçtiğinde erimeyen tungstenden (element 74) yapılmıştır.
- Tüm metaller arasında en düşük erime noktasına sahip olan cıva, termometre ve barometrelerde kullanılır.
- Cıva, oda sıcaklığında sıvı olan tek metaldir.
Demir üçlü
4. gruptaki üç element - demir, kobalt ve nikel - demir üçlüsü olarak bilinecek kadar benzer özelliklere sahiptir.
platin grubu
Rutenyum, rodyum, paladyum, osmiyum, iridyum ve platin, benzer özelliklere sahip oldukları için bazen platin grubu olarak adlandırılır. Diğer elementlerle kolayca birleşmezler. Sonuç olarak, katalizör olarak kullanılabilirler.
İç geçiş elemanları
İç geçiş öğeleri olarak adlandırılan bazı geçiş öğeleri, ana tablonun altına yerleştirilmiştir. Bu elementlere lantanit ve aktinit serileri denir, çünkü bir seri lantan elementi 57'yi takip eder ve diğer seri aktinyum element 89'u takip eder.
Lantanitler - Seryumdan lutesyuma kadar olan ilk seriye lantanitler denir. Lantanitler aynı zamanda nadir toprak olarak da adlandırılır çünkü bir zamanlar kıt oldukları düşünülürdü. Bıçakla kesilebilen yumuşak metallerdir.
Aktinitler - Tüm aktinitler radyoaktiftir. Toryum, protaktinyum ve uranyum, şu anda Dünya'da doğal olarak bulunan tek aktinitler. Diğer tüm aktinitler sentetik elementlerdir. Sentetik elementler laboratuvarlarda ve nükleer reaktörlerde yapılır.
