Періодична система хімічних елементів — це список відомих елементів. У таблиці елементи розміщені в порядку їх атомних номерів, починаючи з найменшого номера. Атомний номер елемента дорівнює числу протонів у цьому конкретному атомі.
Дмитру Менделєєву належить заслуга в розробці сучасної таблиці Менделєєва.
Кожен елемент має квадрат у періодичній системі. У кожному квадраті є 3 частини інформації
- назва елемента
- його офіційний хімічний символ
- його атомний номер
Наприклад, квадрат для заліза буде виглядати приблизно так:
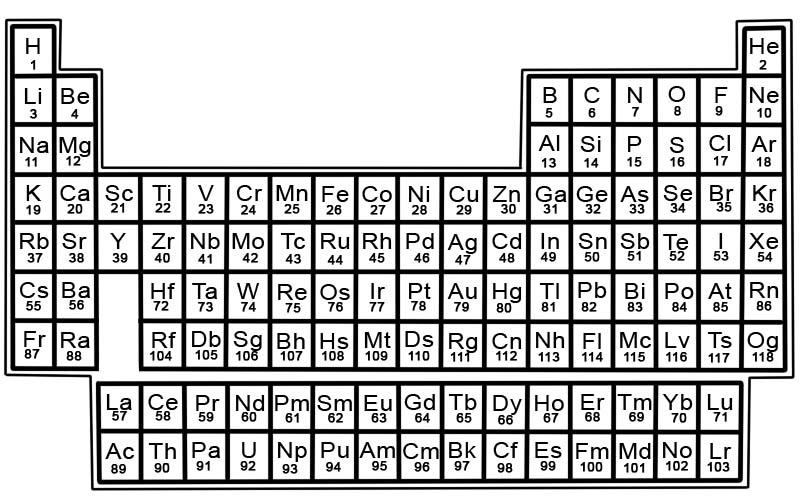
Елементи в періодичній системі розташовані в рядках і стовпцях.
- Рядки називаються періодами. Період - це ряд елементів періодичної системи, властивості яких змінюються поступово і передбачувано.
- Стовпці називаються групами. Періодична таблиця має 18 стовпчиків елементів. Кожен стовпець містить групу або сімейство елементів. Група містить елементи, які мають подібні фізичні або хімічні властивості.
Зони в таблиці Менделєєва
Періодичну систему можна розділити на розділи.
Один розділ складається з перших двох груп, групи 1 і 2, і елементів у групах 3-18. Це репрезентативні елементи. До них відносяться метали, металоїди та неметали.
метали
Приклади: залізо, олово, натрій і плутоній.
- зазвичай твердий при кімнатній температурі (виняток становить ртуть)
- високий блиск (блискучий)
- металевий вигляд
- хороші провідники тепла та електрики
- пластичний (можна згинати та товкти на тонкі листи)
- пластичний (можна втягнути в дріт)
- роз'їдати або окислюватися в повітрі та морській воді
- зазвичай щільний (за винятком літію, калію та натрію)
- може мати дуже високу температуру плавлення
- легко втрачають електрони
Металоїди
Приклади: бор, кремній і миш'як.
- тьмяний або блискучий
- зазвичай проводять тепло і електрику, хоча не так добре, як метали
- часто роблять хороші напівпровідники
- часто існують у кількох формах
- часто пластичні
- часто пластичний
- можуть отримувати або втрачати електрони в реакціях
Неметали
Приклади: кисень, хлор і аргон.
- нудний вигляд
- зазвичай крихкий
- погані провідники тепла та електрики
- зазвичай менш щільні, порівняно з металами
- зазвичай низька температура плавлення твердих тіл, порівняно з металами
- мають тенденцію отримувати електрони в хімічних реакціях
1 і 2 групи
- 1 група - Лужні метали. Приклади: натрій, літій і калій.
- Група 2 – Лужноземельні метали Приклади: берилій, магній, кальцій, барій, радій. Кожен лужноземельний метал щільніший і твердіший і має вищу температуру плавлення, ніж лужний метал за той самий період. Лужноземельні метали є реакційноздатними, але не такими, як лужні метали.
Групи 13-18
13 група – родина Борових
- Приклади: бор (B), алюміній (Al), галій (Ga), індій (In) і талій (Tl).
- Вони мають три валентних електрони.
Група 14 – родина Карбону
- Приклади: вуглець (C), кремній (Si), германій (Ge), олово (Sn) і свинець (Pb).
- Усі вони мають чотири валентні електрони.
Група 15 – Родина азоту
- Приклади: азот (N), фосфор (P), миш'як (As), сурма (Sb) і вісмут (Bi).
- Усі ці елементи мають п’ять валентних електронів.
- Нітроген і Фосфор є неметалами.
16 група – родина Оксигенів
- Приклади: кисень (O), сірка (S), селен (Se), телур (Te) і радіоактивний полоній (Po).
- Ця група має шість валентних електронів
- Вони також відомі як халькогени.
Група 17 – Галогени
- Приклади: фтор (F), хлор (Cl), бром (Br), йод (I) і астат (At).
- Вони мають сім валентних електронів.
- Ця група є першою, що повністю складається з неметалів.
- Галогени мають високу реакційну здатність і тому можуть бути шкідливими або смертельними для біологічних організмів у достатніх кількостях.
- Символ X часто використовується узагальнено для позначення будь-якого галогену.
- Назва «галоген» означає «солетворний». Коли галогени реагують з металами, вони утворюють широкий спектр солей, включаючи кальцій, фторид, хлорид натрію (кухонна сіль), бромід срібла та йодид калію.
Група 18 – Благородні гази
- Існує шість благородних газів – гелій, неон, аргон, криптон, ксенон і радон.
- Усі вони є газами і знаходяться в повітрі. Вони становлять близько 0,96% атмосфери.
- Усі вони одноатомні, тобто кожна молекула є одним атомом.
- Вони майже ніколи не реагують з іншими елементами. Це тому, що вони мають повну 8-електронну зовнішню електронну оболонку.
- Благородні гази мають дуже низьку температуру кипіння та плавлення, що робить їх корисними як кріогенні холодоагенти.
Перехідні метали
- Елементи в групах 3-12 є перехідними.
- Усі вони метали.
- Більшість перехідних елементів зустрічаються в поєднанні з іншими елементами в рудах.
- Кілька перехідних елементів, таких як золото та срібло, зустрічаються як чисті елементи.
- Нитки розжарювання лампочок виготовлені з вольфраму (елемент 74), який має найвищу температуру плавлення з усіх металів і не плавиться під час проходження через нього струму.
- Ртуть, яка має найнижчу температуру плавлення з усіх металів, використовується в термометрах і барометрах.
- Ртуть - єдиний метал, який є рідиною при кімнатній температурі.
Залізна тріада
Три елементи в групі 4 – залізо, кобальт і нікель – мають настільки схожі властивості, що їх називають тріадою заліза.
Платинова група
Рутеній, родій, паладій, осмій, іридій і платину іноді називають платиновою групою, оскільки вони мають схожі властивості. Вони важко поєднуються з іншими елементами. В результаті їх можна використовувати як каталізатори.
Внутрішні перехідні елементи
Деякі перехідні елементи, які називаються внутрішніми перехідними елементами, розміщені під основною таблицею. Ці елементи називаються рядами лантаноїдів і актиноїдів, оскільки один ряд слідує за елементом лантан, елемент 57, а інший ряд слідує за актинієм, елемент 89.
Лантаноїди - перший ряд, від церію до лютецію, називається лантаноїдами. Лантаноїди також називають рідкісноземельними, тому що колись вважалося, що їх мало. Це м’які метали, які можна різати ножем.
Актиніди – усі актиніди радіоактивні. Торій, протактиній і уран є єдиними актиноїдами, які зараз зустрічаються в природі на Землі. Всі інші актиноїди є синтетичними елементами. Синтетичні елементи виготовляють у лабораторіях і ядерних реакторах.
