کیمیائی عناصر کی متواتر جدول معلوم عناصر کی ایک فہرست ہے۔ جدول میں ، عناصر کو ان کے جوہری نمبروں کی ترتیب میں رکھا گیا ہے جس کی شروعات سب سے کم تعداد سے ہوتی ہے۔ کسی عنصر کی ایٹمی تعداد اسی خاص ایٹم میں پروٹون کی تعداد کے برابر ہوتی ہے۔
دیمتری مینڈیلیف کو جدید ادوار کی میز تیار کرنے کا سہرا ملا۔
متواتر جدول میں ہر عنصر کا ایک مربع ہوتا ہے۔ ہر چوک میں معلومات کے 3 ٹکڑے ہیں
- عنصر کا نام
- اس کی سرکاری کیمیکل علامت
- اس کا ایٹم نمبر
مثال کے طور پر ، آئرن کا مربع کچھ اس طرح نظر آئے گا:
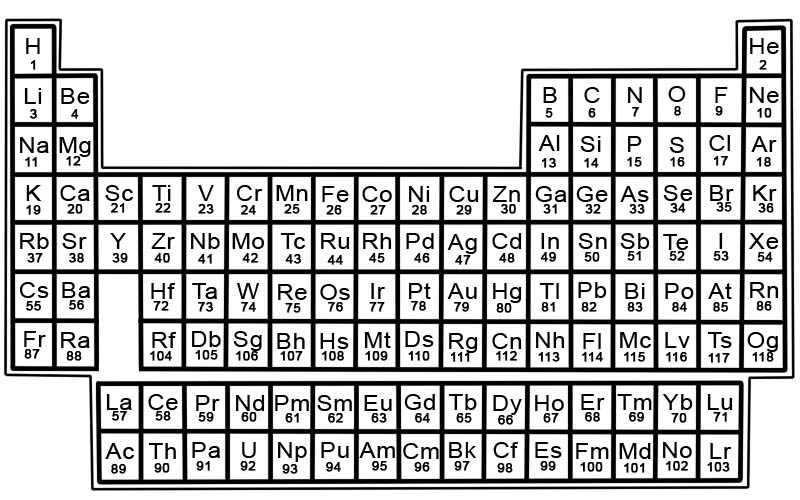
متواتر جدول میں شامل عناصر کو قطار اور کالموں میں ترتیب دیا گیا ہے۔
- قطاروں کو ادوار کہا جاتا ہے۔ ایک ادوار متواتر جدول کے عناصر کی ایک صف ہے جس کی خصوصیات آہستہ آہستہ اور پیش گوئی کے ساتھ بدلی جاتی ہیں۔
- کالمز کو گروپ کہتے ہیں۔ متواتر جدول میں عناصر کے 18 کالم ہوتے ہیں۔ ہر کالم میں عناصر کا ایک گروپ ، یا کنبہ شامل ہوتا ہے۔ ایک گروپ میں ایسے عناصر ہوتے ہیں جن کی جسمانی یا کیمیائی خصوصیات ایک جیسی ہوتی ہیں۔
متواتر میز پر زون
متواتر جدول کو حصوں میں تقسیم کیا جاسکتا ہے۔
ایک حص sectionہ پہلے دو گروپس ، گروپ 1 اور 2 ، اور گروپ 3-18 میں شامل عناصر پر مشتمل ہے۔ یہ نمائندہ عناصر ہیں۔ ان میں دھاتیں ، میٹیلائڈز اور نون میٹل شامل ہیں۔
دھاتیں
مثال کے طور پر: آئرن ، ٹن ، سوڈیم ، اور پلوٹونیم۔
- عام طور پر کمرے کے درجہ حرارت پر ٹھوس (پارا ایک استثناء ہے)
- اعلی چمک (چمکدار)
- دھاتی ظاہری شکل
- گرمی اور بجلی کے اچھے موصل
- قابل عمل (موڑ اور پتلی چادروں میں گولہ باری کی جا سکتی ہے)
- نچلا (تار میں کھینچا جا سکتا ہے)
- ہوا اور سمندری پانی میں کورڈ یا آکسائڈائز
- عام طور پر گھنے (استثنیات میں لتیم ، پوٹاشیم ، اور سوڈیم شامل ہیں)
- پگھلنے کا نقطہ بہت زیادہ ہوسکتا ہے
- آسانی سے الیکٹرانوں کو کھو دیں
میٹللوڈز
مثال کے طور پر: بوران ، سلکان ، اور آرسنک۔
- سست یا چمکدار
- عام طور پر گرمی اور بجلی کا انعقاد کرتے ہیں ، اگرچہ دھاتیں بھی نہیں
- اکثر اچھے سیمیکمڈکٹر بناتے ہیں
- اکثر کئی اقسام میں موجود ہوتا ہے
- اکثر نرم
- اکثر قابل عمل
- رد عمل میں الیکٹرانوں کو حاصل یا کھو سکتے ہیں
نان میٹالس
مثال کے طور پر: آکسیجن ، کلورین اور آرگن۔
- سست ظہور
- عام طور پر آسانی سے
- حرارت اور بجلی کے ناقص موصل
- دھاتوں کے مقابلے میں عام طور پر کم گھنے
- دھاتوں کے مقابلے میں عموما sol سالڈز کا کم پگھلنے کا مقام
- کیمیائی رد عمل میں الیکٹران حاصل کرنے کے لئے ہوتے ہیں
گروپ 1 اور 2
- گروپ 1 - الکلی دھاتیں. مثال کے طور پر: سوڈیم ، لتیم ، اور پوٹاشیم۔
- گروپ 2 - الکلائن زمین کی دھاتیں مثال کے طور پر: بیریلیم ، میگنیشیم ، کیلشیئم ، بیریم ، اور ریڈیم۔ زمین کی ہر ایک دالہ دھات موزوں اور سخت ہوتی ہے اور اسی عرصے میں الکلی دھات سے زیادہ پگھلنے کا مقام رکھتی ہے۔ الکائن زمین کی دھاتیں ردtive عمل کرتی ہیں لیکن الکالی دھاتوں کی طرح رد عمل میں نہیں ہیں۔
گروپس 13 سے 18
گروپ 13 - بورن خاندان
- مثال کے طور پر: بوران (بی) ، ایلومینیم (ال) ، گیلیم (گا) ، انڈیم (میں) ، اور تھیلیم (ٹی ایل)۔
- ان کے پاس تین والینس الیکٹران ہیں۔
گروپ 14 - کاربن کنبہ
- مثال کے طور پر: کاربن (C) ، سلکان (سی) ، جرمینیم (Ge) ، ٹن (ایس این) ، اور سیسہ (Pb)۔
- ان سب کے پاس چار والینس الیکٹران ہیں۔
گروپ 15 - نائٹروجن فیملی
- مثال کے طور پر: نائٹروجن (این) ، فاسفورس (پی) ، آرسنک (ع) ، اینٹیمونی (ایس بی) ، اور بسموت (دو)۔
- ان عناصر میں پانچ والینس الیکٹران ہوتے ہیں۔
- نائٹروجن اور فاسفورس غیر دھاتیں ہیں۔
گروپ 16 - آکسیجن کنبہ
- مثال کے طور پر: آکسیجن (O) ، سلفر (S) ، سیلینیم (Se) ، ٹیلوریم (Te) ، اور تابکار polonium (پو)۔
- اس گروپ میں چھ والینس الیکٹران ہیں
- یہ چالاکجینز کے نام سے بھی جانا جاتا ہے۔
گروپ 17 - ہیلوجنس
- مثال کے طور پر: فلورین (ایف) ، کلورین (سی ایل) ، برومین (بی آر) ، آئوڈین (آئ) ، اور آسٹائٹین (اٹ)۔
- ان کے پاس سات والینس الیکٹران ہیں۔
- یہ گروپ پہلا گروپ ہے جو مکمل طور پر غیر دھاتوں پر مشتمل ہے۔
- ہیلوجن انتہائی رد عمل مند ہیں ، اور اس طرح کافی مقدار میں حیاتیاتی حیاتیات کے لئے نقصان دہ یا مہلک ثابت ہوسکتے ہیں۔
- کسی بھی ہولوجن کا حوالہ دینے کیلئے علامت ایکس اکثر عام طور پر استعمال ہوتا ہے۔
- "ہالوجن" نام کا مطلب ہے "نمک پیدا کرنے والا"۔ جب ہالوجن دھاتوں کے ساتھ رد عمل دیتے ہیں تو وہ وسیع پیمانے پر نمک تیار کرتے ہیں ، جس میں کیلشیم ، فلورائڈ ، سوڈیم کلورائد (ٹیبل نمک) ، سلور برومائڈ اور پوٹاشیم آئوڈائڈ شامل ہیں۔
گروپ 18 - نوبل گیسیں
- چھ نوبل گیسیں ہیں۔ ہیلیم ، نیین ، آرگون ، کرپٹن ، زینون اور راڈن۔
- وہ تمام گیسیں ہیں اور ہوا میں پائے جاتے ہیں۔ وہ ماحول کا تقریبا 0.96٪ حصہ بناتے ہیں۔
- یہ سارے منوومیٹک ہیں ، یعنی ہر ایک انو ایک ہی ایٹم ہے۔
- وہ دوسرے عناصر کے ساتھ تقریبا never کبھی بھی رد عمل ظاہر نہیں کرتے ہیں۔ اس کی وجہ یہ ہے کہ ان کے پاس ایک 8 الیکٹران بیرونی الیکٹران شیل ہے۔
- نوبل گیسوں میں بہت کم ابلتے اور پگھلنے والے مقامات ہوتے ہیں ، جو انہیں کرائیوجینک ریفریجریٹ کی حیثیت سے مفید بناتے ہیں۔
منتقلی دھاتیں
- گروپ 3-12 میں شامل عناصر منتقلی کے عناصر ہیں۔
- وہ سب دھاتیں ہیں۔
- بیشتر منتقلی کے عناصر کچ دھات میں دوسرے عناصر کے ساتھ مل پائے جاتے ہیں۔
- سونے چاندی جیسے کچھ منتقلی عناصر خالص عناصر کے بطور پائے جاتے ہیں۔
- لائٹ بلب کے تاروں ٹنسٹن (عنصر 74) سے بنے ہیں جس میں کسی بھی دھات کا سب سے زیادہ پگھلنے والا نقطہ ہوتا ہے اور جب کوئی کرنٹ اس میں سے گزرتا ہے تو پگھل نہیں ہوتا ہے۔
- مرکری ، جس میں کسی بھی دھات کا سب سے کم پگھلنے والا مقام ہوتا ہے ، ترمامیٹر اور بیرومیٹر میں استعمال ہوتا ہے۔
- مرکری واحد دھات ہے جو کمرے کے درجہ حرارت میں مائع ہے۔
آئرن ٹرائیڈ
گروپ 4 میں تین عناصر۔ آئرن ، کوبالٹ اور نکل - ایسی ہی خصوصیات رکھتے ہیں کہ انہیں لوہے کے تپائی کے نام سے جانا جاتا ہے۔
پلاٹینم گروپ
روٹینیم ، روڈیم ، پیلڈیم ، آسیمیم ، آئریڈیم ، اور پلاٹینم کو بعض اوقات پلاٹینم گروپ بھی کہا جاتا ہے کیونکہ ان میں ایسی خصوصیات ہیں۔ وہ دوسرے عناصر کے ساتھ آسانی سے جوڑ نہیں پاتے ہیں۔ نتیجے کے طور پر ، وہ اتپریرک کے طور پر استعمال کیا جا سکتا ہے.
اندرونی منتقلی کے عناصر
داخلی منتقلی کے عنصر کہلانے والے کچھ منتقلی عناصر ، مرکزی میز کے نیچے رکھے جاتے ہیں۔ ان عناصر کو لانٹینائڈ اور ایکٹینائڈ سیریز کہا جاتا ہے کیونکہ ایک سیریز عنصر لانٹینم ، عنصر 57 ، اور دوسری سیریز ایکٹینیم ، عنصر 89 کی پیروی کرتی ہے۔
لینتھانیڈس - سیریم سے لے کر لٹیٹیم تک پہلی سیریز ، لانٹینائڈس کہلاتی ہے۔ لانٹینائڈز کو نایاب زمین بھی کہا جاتا ہے کیونکہ ایک وقت میں یہ خیال کیا جاتا تھا کہ اس کی کمی ہے۔ وہ نرم دھاتیں ہیں جن کو چاقو سے کاٹا جاسکتا ہے۔
ایکٹینائڈس - تمام ایکٹائنائڈ تابکار ہیں۔ تھوریم ، پروٹیکٹنیم اور یورینیم ہی واحد ایکٹینائڈس ہیں جو اب زمین پر قدرتی طور پر پائے جاتے ہیں۔ باقی تمام ایکٹینائڈس مصنوعی عنصر ہیں۔ مصنوعی عناصر لیبارٹریوں اور جوہری ری ایکٹروں میں بنائے جاتے ہیں۔
