Bảng tuần hoàn các nguyên tố hóa học là danh sách các nguyên tố đã biết. Trong bảng, các nguyên tố được xếp theo thứ tự số hiệu nguyên tử của chúng bắt đầu bằng số thấp nhất. Số nguyên tử của một nguyên tố giống với số proton trong nguyên tử cụ thể đó.
Dmitri Mendeleev được công nhận vì đã thiết kế ra bảng tuần hoàn hiện đại.
Mỗi nguyên tố có một ô vuông trong bảng tuần hoàn. Có 3 phần thông tin trong mỗi ô vuông
- tên của phần tử
- ký hiệu hóa học chính thức của nó
- số nguyên tử của nó
Ví dụ, hình vuông cho bàn ủi sẽ trông giống như sau:
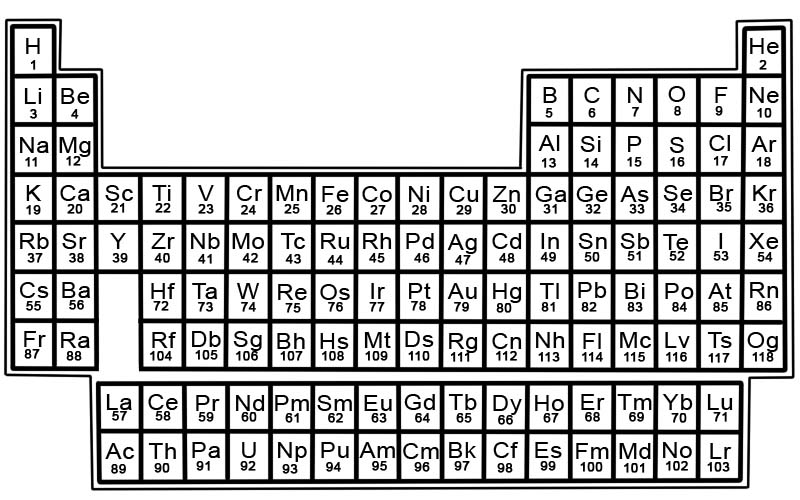
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo hàng và cột.
- Hàng được gọi là chu kỳ. Chu kỳ là một dãy các nguyên tố trong bảng tuần hoàn có tính chất thay đổi dần dần và có thể dự đoán được.
- Các cột được gọi là nhóm. Bảng tuần hoàn có 18 cột nguyên tố. Mỗi cột chứa một nhóm hoặc họ, các phần tử. Một nhóm chứa các nguyên tố có tính chất vật lý hoặc hóa học tương tự nhau.
Các khu vực trong bảng tuần hoàn
Bảng tuần hoàn có thể được chia thành nhiều phần.
Một phần bao gồm hai nhóm đầu tiên, Nhóm 1 và 2, và các phần tử trong Nhóm 3-18. Đây là những yếu tố đại diện. Chúng bao gồm kim loại, kim loại và phi kim.
Kim loại
Ví dụ: sắt, thiếc, natri và plutonium.
- thường rắn ở nhiệt độ phòng (thủy ngân là một ngoại lệ)
- độ bóng cao (sáng bóng)
- ngoại hình kim loại
- chất dẫn nhiệt và điện tốt
- dễ uốn (có thể uốn cong và đập thành các tấm mỏng)
- dễ uốn (có thể được kéo thành dây)
- ăn mòn hoặc oxy hóa trong không khí và nước biển
- thường đậm đặc (ngoại lệ bao gồm lithium, kali và natri)
- có thể có nhiệt độ nóng chảy rất cao
- dễ dàng mất điện tử
Metalloids
Ví dụ: bo, silicon và asen.
- xỉn màu hoặc sáng bóng
- thường dẫn nhiệt và điện, mặc dù không tốt như kim loại
- thường tạo ra chất bán dẫn tốt
- thường tồn tại ở một số dạng
- thường dễ uốn
- thường dễ uốn
- có thể thu được hoặc mất electron trong các phản ứng
Phi kim
Ví dụ: oxy, clo và argon.
- vẻ ngoài buồn tẻ
- thường giòn
- dẫn nhiệt và điện kém
- thường ít đặc hơn, so với kim loại
- nhiệt độ nóng chảy thường thấp của chất rắn, so với kim loại
- có xu hướng đạt được các electron trong các phản ứng hóa học
Nhóm 1 và 2
- Nhóm 1 - Các kim loại kiềm. Ví dụ: natri, liti và kali.
- Nhóm 2 - Kim loại kiềm thổ Ví dụ: beri, magiê, canxi, bari và radium. Mỗi kim loại kiềm thổ đều đặc hơn, cứng hơn và có nhiệt độ nóng chảy cao hơn kim loại kiềm trong cùng chu kỳ. Các kim loại kiềm thổ đều có phản ứng nhưng không phản ứng như kim loại kiềm.
Nhóm 13 đến 18
Nhóm 13 - Gia đình Boron
- Ví dụ: bo (B), nhôm (Al), gali (Ga), indium (In) và thallium (Tl).
- Chúng có ba electron hóa trị.
Nhóm 14 - Họ cacbon
- Ví dụ: cacbon (C), silic (Si), gecmani (Ge), thiếc (Sn) và chì (Pb).
- Tất cả chúng đều có bốn electron hóa trị.
Nhóm 15 - Họ nitơ
- Ví dụ: nitơ (N), phốt pho (P), asen (As), antimon (Sb) và bitmut (Bi).
- Các nguyên tố này đều có năm electron hóa trị.
- Nitơ và Phốt pho là những phi kim loại.
Nhóm 16 - Họ ôxy
- Ví dụ: oxy (O), lưu huỳnh (S), selen (Se), tellurium (Te) và poloni phóng xạ (Po).
- Nhóm này có sáu điện tử hóa trị
- Chúng còn được gọi là chalcogens.
Nhóm 17 - Halogens
- Ví dụ: flo (F), clo (Cl), brom (Br), iot (I) và astatine (At).
- Chúng có bảy electron hóa trị.
- Nhóm này là nhóm đầu tiên hoàn toàn bao gồm các phi kim loại.
- Halogens có phản ứng cao, và như vậy có thể gây hại hoặc gây chết cho các sinh vật sinh học với số lượng vừa đủ.
- Kí hiệu X thường được sử dụng chung để chỉ bất kỳ halogen nào.
- Tên "halogen" có nghĩa là "tạo ra muối". Khi halogen phản ứng với kim loại, chúng tạo ra nhiều loại muối, bao gồm canxi, florua, natri clorua (muối ăn), bạc bromua và kali iođua.
Nhóm 18 - Khí quý
- Có sáu loại khí quý - heli, neon, argon, krypton, xenon và radon.
- Chúng đều là chất khí và được tìm thấy trong không khí. Chúng chiếm khoảng 0,96% bầu khí quyển.
- Tất cả chúng đều là đơn nguyên tử, nghĩa là mỗi phân tử là một nguyên tử.
- Chúng hầu như không bao giờ phản ứng với các yếu tố khác. Điều này là do chúng có đầy đủ 8 electron lớp vỏ ngoài cùng.
- Khí quý có điểm sôi và điểm nóng chảy rất thấp, điều này làm cho chúng hữu ích như chất làm lạnh đông lạnh.
Kim loại chuyển tiếp
- Các nguyên tố trong Nhóm 3-12 là các nguyên tố chuyển tiếp.
- Chúng đều là kim loại.
- Hầu hết các nguyên tố chuyển tiếp được tìm thấy kết hợp với các nguyên tố khác trong quặng.
- Một số nguyên tố chuyển tiếp như vàng và bạc được tìm thấy là nguyên tố tinh khiết.
- Dây tóc của bóng đèn được làm bằng vonfram (nguyên tố 74) có nhiệt độ nóng chảy cao nhất trong số các kim loại và sẽ không nóng chảy khi có dòng điện chạy qua.
- Thủy ngân, có nhiệt độ nóng chảy thấp nhất trong số các kim loại, được sử dụng trong nhiệt kế và khí áp kế.
- Thủy ngân là kim loại duy nhất ở dạng lỏng ở nhiệt độ phòng.
Bộ ba sắt
Ba nguyên tố trong nhóm 4 - sắt, coban và niken - có các đặc tính tương tự đến mức chúng được gọi là bộ ba sắt.
Nhóm bạch kim
Ruthenium, rhodium, palladium, osmium, iridium, và platinum đôi khi được gọi là nhóm bạch kim vì chúng có các tính chất tương tự. Chúng không kết hợp dễ dàng với các yếu tố khác. Kết quả là, chúng có thể được sử dụng làm chất xúc tác.
Các yếu tố chuyển tiếp bên trong
Một số yếu tố chuyển tiếp, được gọi là yếu tố chuyển tiếp bên trong, được đặt bên dưới bảng chính. Các nguyên tố này được gọi là dãy lantan và dãy actini vì một dãy theo sau nguyên tố lantan, nguyên tố 57, và dãy còn lại theo sau nguyên tố actini, nguyên tố 89.
Lanthanides - Chuỗi đầu tiên, từ xeri đến lutetium, được gọi là Lanthanides. Lồng đèn còn được gọi là đất hiếm vì có thời chúng được cho là khan hiếm. Chúng là kim loại mềm có thể được cắt bằng dao.
Actinides - Tất cả các actinide đều có tính phóng xạ. Thori, protactinium và uranium là những actinides duy nhất hiện nay được tìm thấy tự nhiên trên Trái đất. Tất cả các actinide khác đều là các nguyên tố tổng hợp. Các nguyên tố tổng hợp được thực hiện trong các phòng thí nghiệm và lò phản ứng hạt nhân.
