leerdoelen
In deze les zullen de leerlingen
- Beschrijf osmose en osmotische druk
- Beschrijf oplosmiddel en opgeloste stof
- Beschrijf de oplossing en verschillende soorten oplossingen
- Begrijp het effect van osmose in plantencellen
- Begrijp het effect van osmose in dierlijke cellen
Wat is osmose?
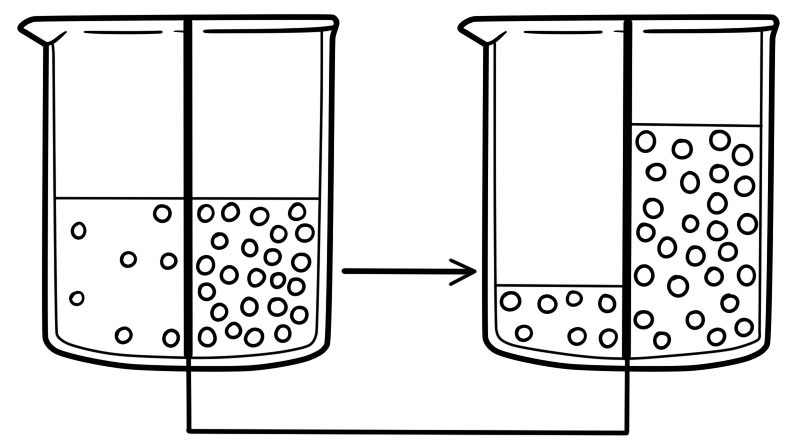
Osmose is de beweging van water van een hoge concentratie naar een lage concentratie door een semi-permeabel membraan. Osmose verwijst alleen naar de beweging van watermoleculen. Het is een speciaal soort diffusie.
Het is passief transport, wat betekent dat er geen energie voor nodig is.
Een verdunde oplossing bevat een hoge concentratie watermoleculen, terwijl een geconcentreerde oplossing een lage concentratie watermoleculen bevat.
De verschillende concentraties opgeloste stoffen aan de twee zijden van het membraan veroorzaken osmotische druk. Wanneer osmose plaatsvindt, beweegt water van de zijkant van het membraan met een lagere osmotische druk naar de kant van het membraan met de hogere hoeveelheid osmotische druk.
Wanneer de waterconcentratie aan beide zijden van het membraan hetzelfde is, zal de beweging van het watermolecuul in beide richtingen hetzelfde zijn. Er zal geen netto beweging van watermoleculen zijn.
Osmose over levende cellen
Cellen bevatten verdunde oplossingen van ionen, suikers en aminozuren.
Het celmembraan is gedeeltelijk permeabel. Water zal door osmose in en uit cellen bewegen.
Een belangrijk voorbeeld van osmose is de beweging van vloeibare (oplosmiddel) moleculen over een celmembraan naar een cel met een hogere concentratie opgeloste stoffen.
Wat is osmotische druk?
Osmotische druk is de druk die de diffusie van water door semi-permeabele membranen veroorzaakt. Het neemt toe als gevolg van een toename van de concentratie van opgeloste stoffen in de oplossing.
Wat zijn oplosmiddelen en opgeloste stoffen?
Osmose houdt zich bezig met chemische oplossingen. Oplossingen bestaan uit twee delen: een oplosmiddel en een opgeloste stof.
Wanneer een opgeloste stof oplost in een oplosmiddel, wordt het eindproduct een oplossing genoemd. Zout water is een voorbeeld van een oplossing; zout is de opgeloste stof en water is het oplosmiddel.
Wat zijn de verschillende soorten oplossingen?
Er zijn drie soorten osmose-oplossingen: de isotone oplossing, hypotone oplossing en hypertone oplossing. Verschillende soorten oplossingen hebben verschillende effecten op cellen als gevolg van osmose.
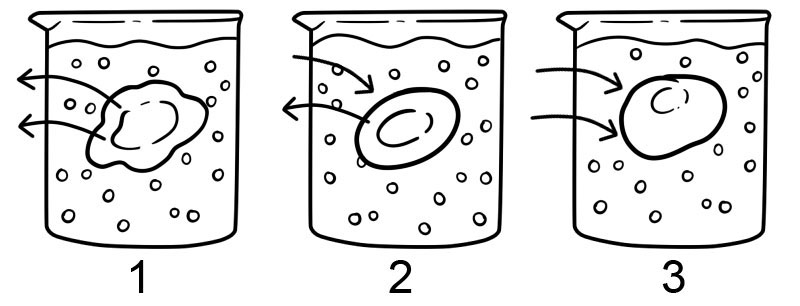
1. Hypertoon – Een hypertone oplossing is het tegenovergestelde van een hypotone oplossing; er is meer opgeloste stof buiten de cel dan erin. In dit type oplossing beweegt het water uit de cel en zorgt ervoor dat de cel verschrompelt.
2. Isotoon - Een isotone oplossing heeft dezelfde concentratie opgeloste stoffen, zowel binnen als buiten de cel. Onder deze omstandigheden is er geen netto beweging van oplosmiddel; in dit geval is de hoeveelheid water die het celmembraan binnenkomt en verlaat gelijk.
3. Hypotoon - In een hypotone oplossing is er een hogere concentratie opgeloste stoffen in de cel dan buiten de cel. In een hypotone oplossing beweegt het water de cel in en kan de cel opzwellen; cellen die geen celwand hebben, zoals dierlijke cellen, kunnen in dit type oplossing exploderen.
Effecten van osmose in plantencellen
- hypotoon
- hypertoon
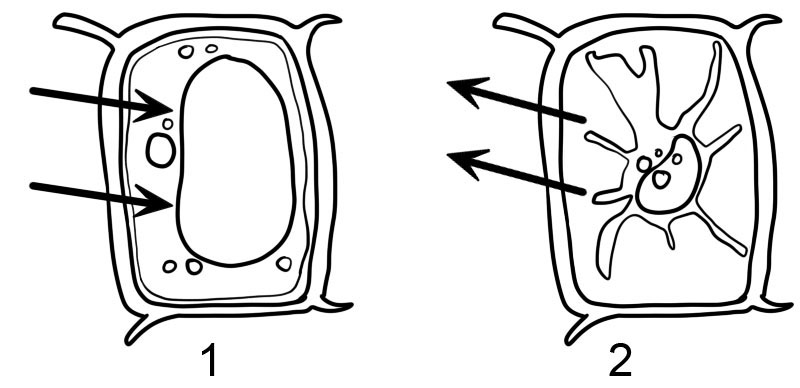
- Plantencellen zijn omgeven door een stijve celwand. Wanneer de plantencel in een hypotone oplossing wordt geplaatst, neemt deze door osmose water op en begint te zwellen, maar de celwand voorkomt dat deze barst. Men zegt dat de plantencel 'gezwollen' is geworden, dat wil zeggen opgezwollen en hard. De druk in de cel stijgt totdat deze interne druk gelijk is aan de druk buiten. Deze vloeistof- of hydrostatische druk wordt 'turgordruk' genoemd en voorkomt de verdere netto opname van water.
- Turgiditeit is erg belangrijk voor planten omdat het helpt bij het behoud van de stijfheid en stabiliteit van plantenweefsel, en omdat elke cel een turgordruk uitoefent op zijn buurman, creëert het plantweefselspanning waardoor de groene delen van de plant kunnen 'opstaan' in het zonlicht.
- Wanneer een plantencel in een hypertone oplossing wordt geplaatst, diffundeert het water uit het cytoplasma van de cel naar buiten en wordt de plantencel 'slap' genoemd. Als de plantencel vervolgens onder een microscoop wordt bekeken, zal worden opgemerkt dat het cytoplasma is gekrompen en van de celwand is weggetrokken. Dit fenomeen wordt plasmolyse genoemd. Het proces wordt omgekeerd zodra de cellen worden overgebracht naar een hypotone oplossing (deplasmolyse).
- Wanneer een plantencel in een isotone oplossing wordt geplaatst, zou een fenomeen optreden dat 'beginnende plasmolyse' wordt genoemd. 'Begin' betekent 'op het punt staan'. Hoewel de cel niet geplasmoslyseerd is, is hij ook niet gezwollen. Wanneer dit gebeurt, hangen de groene delen van de plant af en kunnen ze de bladeren niet in het zonlicht houden.
Effecten van osmose in dierlijke cellen
- Dierlijke cellen hebben geen celwanden, dus in hypotone oplossingen zwellen dierlijke cellen op en exploderen. Als er te veel water in de dierlijke cel komt, kan deze barsten - dit wordt lysis genoemd. Ze kunnen niet gezwollen worden omdat er geen celwand is om te voorkomen dat de cel barst. Wanneer de cel dreigt te barsten, zullen organellen, contractiele vacuolen genaamd, water uit de cel pompen om te voorkomen dat dit gebeurt.
- In hypertone oplossingen diffundeert water door osmose uit de cel en krimpt de cel. Als er te veel water de dierlijke cel verlaat, kan deze krimpen - dit wordt crenatie genoemd. De dierlijke cel moet dus altijd omgeven zijn door een isotone oplossing. In het menselijk lichaam zorgen de nieren voor het noodzakelijke regelmechanisme voor het bloedplasma. De concentratie van water en zout die door de nieren uit het bloed worden verwijderd, wordt geregeld door een deel van de hersenen dat de hypothalamus wordt genoemd. Het proces van het reguleren van de concentratie van water en minerale zouten in het bloed wordt osmoregulatie genoemd.
- Dieren die op het droge leven, moeten water besparen, net als dieren die in zout zeewater leven. Dieren die in zoet water leven hebben het tegenovergestelde probleem; ze moeten overtollig water zo snel kwijt als het door osmose in hun lichaam komt.


