Lärandemål
I den här lektionen kommer eleverna
- Beskriv osmos och osmotiskt tryck
- Beskriv lösningsmedel och löst ämne
- Beskriv lösning och olika typer av lösningar
- Förstå effekten av osmos i växtceller
- Förstå effekten av osmos i djurceller
Vad är osmos?
Osmos är förflyttning av vatten från en hög koncentration till en låg koncentration genom ett semipermeabelt membran. Osmos hänvisar endast till förflyttning av vattenmolekyler. Det är en speciell typ av diffusion.
Det är passiv transport vilket innebär att det inte kräver energi för att appliceras.
En utspädd lösning innehåller en hög koncentration av vattenmolekyler, medan en koncentrerad lösning innehåller en låg koncentration av vattenmolekyler.
De olika koncentrationerna av lösta ämnen på de två sidorna av membranet orsakar osmotiskt tryck. När osmos inträffar, rör sig vatten från sidan av membranet med en lägre mängd osmotiskt tryck till sidan av membranet med den högre mängden osmotiskt tryck.
När koncentrationen av vatten är densamma på båda sidor av membranet, kommer vattenmolekylernas rörelse att vara densamma i båda riktningarna. Det kommer inte att finnas någon nettorörelse av vattenmolekyler.
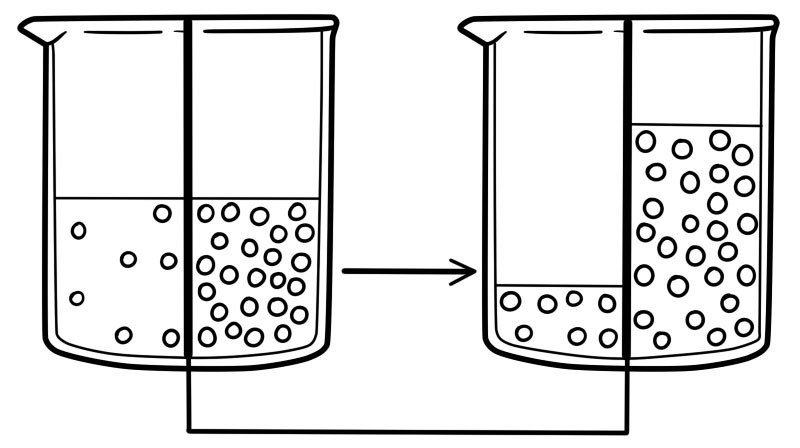
Osmos över levande celler
Celler innehåller utspädda lösningar av joner, sockerarter och aminosyror.
Cellmembranet är delvis permeabelt. Vatten kommer att flytta in i och ut ur celler genom osmos.
Ett viktigt exempel på osmos är förflyttningen av flytande (lösningsmedel) molekyler över ett cellmembran till en cell med en högre koncentration av lösta ämnen.
Vad är osmotiskt tryck?
Osmotiskt tryck är det tryck som orsakar diffusion av vatten genom semipermeabla membran. Den ökar på grund av en ökning av koncentrationen av lösta ämnen i lösningen.
Vad är lösningsmedel och lösta ämnen?
Osmos handlar om kemiska lösningar. Lösningar har två delar - ett lösningsmedel och ett löst ämne.
När ett löst ämne löses i ett lösningsmedel kallas slutprodukten en lösning. Saltvatten är ett exempel på en lösning; salt är det lösta ämnet och vatten är lösningsmedlet.
Vilka olika typer av lösningar finns det?
Det finns tre typer av osmoslösningar - den isotoniska lösningen, hypotonisk lösning och hypertonisk lösning. Olika typer av lösningar har olika inverkan på celler på grund av osmos.
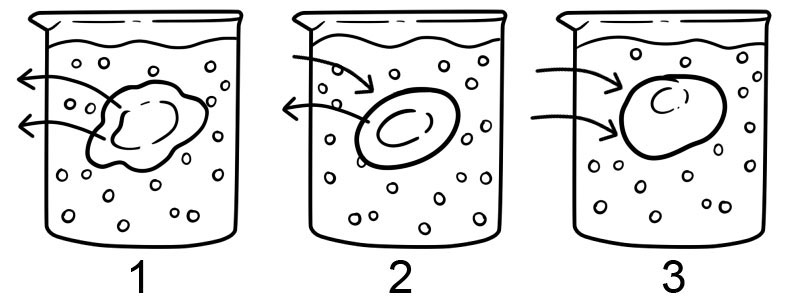
1. Hypertonisk – En hypertonisk lösning är motsatsen till en hypotonisk lösning; det finns mer löst ämne utanför cellen än inuti den. I denna typ av lösning rör sig vattnet ut ur cellen och får cellen att skrumpna ihop.
2. Isotonisk – En isoton lösning har samma koncentration av lösta ämnen både inuti och utanför cellen. Under dessa förhållanden finns det ingen nettorörelse av lösningsmedel; i detta fall är mängden vatten som kommer in i och ut ur cellens membran lika stor.
3. Hypotonisk – I en hypoton lösning finns det en högre koncentration av lösta ämnen inuti cellen än utanför cellen. I en hypoton lösning rör sig vattnet in i cellen och kan få cellen att svälla; celler som inte har en cellvägg, såsom djurceller, kan explodera i denna typ av lösning.
Effekter av osmos i växtceller
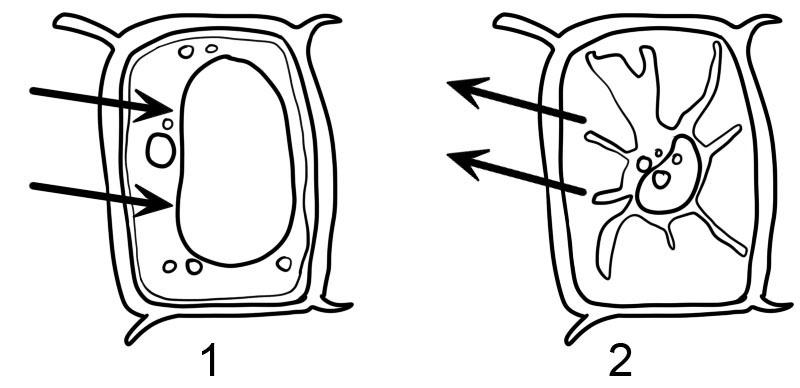
- Hypotonisk
- Hypertonisk
- Växtceller är inneslutna av en stel cellvägg. När växtcellen placeras i en hypoton lösning tar den upp vatten genom osmos och börjar svälla, men cellväggen hindrar den från att spricka. Växtcellen sägs ha blivit 'turgid' dvs svullen och hård. Trycket inuti cellen stiger tills detta inre tryck är lika med trycket utanför. Detta vätske- eller hydrostatiska tryck kallas "turgortryck" och det förhindrar ytterligare nettointag av vatten.
- Turgiditet är mycket viktigt för växter eftersom det hjälper till med att upprätthålla styvhet och stabilitet hos växtvävnaden, och eftersom varje cell utövar ett turgortryck på sin granne, skapar den växtvävnadsspänningar som gör att de gröna delarna av växten kan "stå upp" in i solljuset.
- När en växtcell placeras i en hypertonisk lösning diffunderar vattnet inifrån cellens cytoplasma ut och växtcellen sägs ha blivit "slapp". Om växtcellen sedan observeras i mikroskop kommer det att märkas att cytoplasman har krympt och dragit sig bort från cellväggen. Detta fenomen kallas plasmolys. Processen vänds så snart cellerna överförs till en hypoton lösning (deplasmolys).
- När en växtcell placeras i en isoton lösning sägs ett fenomen som kallas "begynnande plasmolys" inträffa. 'Begynnande' betyder 'på väg att vara'. Även om cellen inte är plasmoslyserad, är den inte heller turgid. När detta händer sjunker de gröna delarna av växten och kan inte hålla löven uppe i solljuset.
Effekter av osmos i djurceller
- Djurceller har inga cellväggar så i hypotona lösningar sväller djurceller upp och exploderar. Om för mycket vatten kommer in i djurcellen kan den brista – detta kallas lysis. De kan inte bli turgida eftersom det inte finns någon cellvägg som hindrar cellen från att spricka. När cellen riskerar att spricka kommer organeller som kallas kontraktila vakuoler att pumpa ut vatten ur cellen för att förhindra att detta händer.
- I hypertona lösningar diffunderar vatten ut ur cellen på grund av osmos och cellen krymper. Om för mycket vatten lämnar djurcellen kan den krympa – detta kallas kreation. Djurcellen måste alltså alltid omges av en isoton lösning. I människokroppen tillhandahåller njurarna den nödvändiga regleringsmekanismen för blodplasman. Koncentrationen av vatten och salt som avlägsnas från blodet av njurarna styrs av en del av hjärnan som kallas hypotalamus. Processen att reglera koncentrationen av vatten och mineralsalter i blodet kallas osmoreglering.
- Djur som lever på torra land måste spara vatten, liksom djur som lever i salt havsvatten. Djur som lever i sötvatten har det motsatta problemet; de måste bli av med överflödigt vatten så fort som det kommer in i deras kroppar genom osmos.


