أهداف التعلم
سنتعلم في هذا الدرس
- ما هي الانزيمات؟
- الخصائص الرئيسية للإنزيمات
- كيف تعمل الانزيمات؟
- فرضية القفل والمفتاح
- الفرضية المستحثة
- العوامل الرئيسية التي تؤثر على نشاط الإنزيم
- ستة أنواع مختلفة من الإنزيمات
ما هي الانزيمات؟
الإنزيمات هي محفزات بيولوجية تعمل على تسريع التفاعلات الكيميائية دون أن تتغير نفسها في هذه العملية. يتحكم النظام الحي في نشاطه من خلال الإنزيمات.
بعض الأمثلة على الإنزيمات
- اللاكتاز - يحلل اللاكتوز إلى جلوكوز وجلاكتوز
- الكاتالاز - يكسر بيروكسيد الهيدروجين إلى الماء والأكسجين
- سينثاز الجليكوجين - يحفز تكوين روابط جليكوزية بين جزيئات الجلوكوز
- ATPase - يقوم بتقسيم ATP إلى ADP ، مما ينتج الطاقة
ما هي الخصائص الرئيسية للانزيمات؟
- الوظيفة الأساسية للإنزيم هي زيادة معدل التفاعل.
- الإنزيمات محددة أي أن لها شكل معين ، وبالتالي فإن ركيزة معينة فقط ستناسب موقعها النشط
- يتم تنظيم الإنزيمات من حالة النشاط المنخفض إلى النشاط العالي والعكس صحيح
كيف تعمل الإنزيمات؟
تتطلب معظم التفاعلات في الخلية درجات حرارة عالية جدًا للبدء ، مما يؤدي إلى تدمير الخلية. تعمل الإنزيمات عن طريق خفض طاقة التنشيط للتفاعل. يتم تقليل طاقة التنشيط للتفاعل عن طريق وضع الضغط على الروابط داخل الجزيء ، أو عن طريق تثبيت الجزيئات قريبة من بعضها البعض. وهذا يزيد من احتمالية حدوث تفاعل ويقلل من الطاقة المطلوبة لبدء تشغيله.
يشار إلى الجزيء الذي يرتبط به الإنزيم باسم الركيزة. ترتبط الركيزة بقسم صغير من الإنزيم المشار إليه بالموقع النشط. يسمى الجزيء المنتج في نهاية التفاعل "منتج". بمجرد اكتمال التفاعل ، يطلق الإنزيم المنتج ويكون جاهزًا للارتباط مع ركيزة أخرى.
هناك نظريتان لشرح عمل الإنزيم
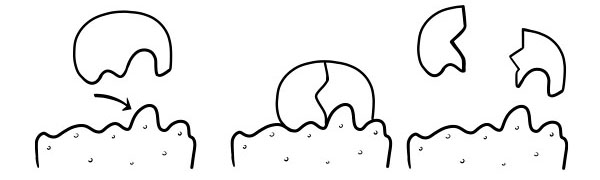
القفل والنظرية الرئيسية
افترض لأول مرة في عام 1894 من قبل إميل فيشر. فرضية القفل والمفتاح هي نموذج لكيفية تفاعلات الإنزيمات لركيزة المحفز. يوضح أن شكل المواقع النشطة للأنزيمات مكمل تمامًا لشكل الركيزة. عندما يتصادم جزيء الركيزة مع إنزيم يكون شكل موقعه النشط مكملًا ، فإن الركيزة سوف تتناسب مع الموقع النشط ويتشكل مركب إنزيم الركيزة. سوف يحفز الإنزيم التفاعل ، وستشكل المنتجات ، مع الإنزيم ، مركب منتج إنزيمي. وفقًا لهذا النموذج ، من الممكن أن يحفز الإنزيم تفاعلًا عكسيًا.
الفرضية المستحثة
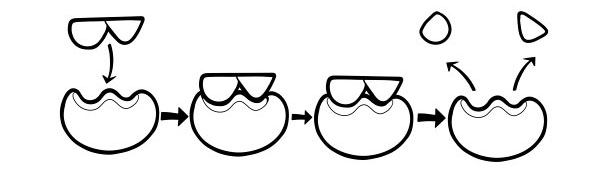
هذا نموذج أحدث وأكثر قبولًا على نطاق واسع لوصف طريقة عمل الإنزيمات. تنص على أن شكل المواقع النشطة ليس مكملاً تمامًا ولكنه يغير الشكل في وجود ركيزة معينة لتصبح مكملة.
عندما يتصادم جزيء الركيزة مع إنزيم ، إذا كان تكوينه صحيحًا على وجه التحديد ، فإن شكل الموقع النشط للإنزيم سيتغير بحيث تتناسب الركيزة مع مركب الركيزة وأنزيم. يتم بعد ذلك تحفيز التفاعل وشكل معقد لمنتج الإنزيم.
العوامل التي تؤثر على نشاط الإنزيم
يمكن أن تؤثر بيئة الإنزيم والركيزة على سرعة التفاعل. في بعض الحالات ، يمكن أن تتسبب البيئة في توقف الإنزيم عن العمل أو حتى التفكك. عندما يتوقف إنزيم عن العمل ، فإننا نسميه "مشوه".
فيما يلي بعض العوامل التي يمكن أن تؤثر على نشاط الإنزيم:
- درجة الحرارة - يمكن أن تؤثر درجة الحرارة على معدل التفاعل. كلما ارتفعت درجة الحرارة ، كان التفاعل أسرع. ومع ذلك ، فإن زيادة أو تقليل درجة الحرارة خارج نطاق مقبول يمكن أن يؤثر على الروابط الكيميائية في الموقع النشط ، مما يجعلها أقل ملاءمة لربط الركائز. قد تؤدي درجات الحرارة المرتفعة جدًا إلى انحلال الإنزيم ، وفقدان شكله ونشاطه.
- يمكن أن يؤثر الرقم الهيدروجيني - الرقم الهيدروجيني أيضًا على وظيفة الإنزيم. غالبًا ما تحتوي بقايا الأحماض الأمينية في الموقع النشط على خصائص حمضية أو أساسية مهمة للتحفيز. يمكن أن تؤثر التغييرات في الأس الهيدروجيني على هذه المخلفات وتجعل من الصعب على الركائز الارتباط. تعمل الإنزيمات بشكل أفضل في نطاق درجة حموضة معينة ، وكما هو الحال مع درجة الحرارة ، يمكن أن تؤدي قيم الأس الهيدروجيني القصوى (الحمضية أو الأساسية) إلى انحلال الإنزيمات.
- تركيز الإنزيمات والركيزة - يزداد معدل التفاعل مع زيادة تركيز الركيزة حتى نقطة ، والتي لا تؤدي بعدها أي زيادة أخرى في تركيز الركيزة إلى حدوث تغير كبير في معدل التفاعل. يحدث هذا لأنه بعد تركيز معين من الركيزة ، تكون جميع المواقع النشطة على الإنزيم ممتلئة ولا يمكن أن يحدث أي تفاعل إضافي.
- المثبطات - المثبطات هي جزيئات مصممة خصيصًا لوقف نشاط الإنزيمات. قد يبطئون التفاعل أو يوقفونه تمامًا. ترتبط بعض المثبطات بالإنزيم مما يتسبب في تغير شكله ولا يعمل بشكل صحيح. عكس المانع هو المنشط الذي يمكن أن يساعد في تسريع التفاعل.
أنواع الإنزيمات
يتكون جسم الإنسان من ست مجموعات أو فئات رئيسية من الإنزيمات:
- إنزيمات الأكسدة - تعزز هذه الإنزيمات معدل الأكسدة وتفاعلات الاختزال. في هذه التفاعلات ، وتسمى أيضًا تفاعلات الأكسدة والاختزال ، يتخلى أحد المتفاعلات عن زوج من الإلكترونات التي يكتسبها متفاعل آخر. يقال أن المتبرع بالزوج الإلكترون يتأكسد ويعمل كعامل اختزال ، في حين أن المتلقي بالزوج الإلكترونى يتم اختزاله يسمى العامل المؤكسد. تتضمن الأمثلة أوكسيديز السيتوكروم ونزعة هيدروجين اللاكتات.
- ترانسفيراز - هذه الإنزيمات تسرع جنباً إلى جنب مع نقل مجموعات الذرات ، مثل مجموعات الميثيل (CH 3 ) ، الأسيتيل (CH 3 CO) أو الأمينية (NH 2 ) ، من جزيء إلى جزيء آخر. خلات كيناز و deaminase ألانين هي أمثلة على ترانسفرازات.
- Hydrolases - تسرع هذه الإنزيمات تفاعلات التحلل المائي. تستخدم تفاعلات التحلل المائي الماء (H 2 O) لتقسيم رابطة في جزيء لإنشاء منتجين ابنتين ، عادة عن طريق لصق -OH (مجموعة الهيدروكسيل) من الماء إلى أحد المنتجات و- H (ذرة الهيدروجين) إلى الأخرى. في هذه الأثناء ، يتشكل جزيء جديد من الذرات التي تتحلل من مكونات -H و -OH. الإنزيمات الهضمية الليباز والسكراز عبارة عن هيدرولات.
- الليياز - تعزز هذه الإنزيمات معدل إضافة مجموعة جزيئية واحدة إلى رابطة مزدوجة أو إزالة مجموعتين من الذرات القريبة لإنشاء رابطة مزدوجة. تعمل هذه مثل hydrolases ، باستثناء أن المكون الذي تمت إزالته لا يتم إزاحته بواسطة الماء أو أجزاء من الماء. تشتمل هذه الفئة من الإنزيمات على أكسالات ديكاربوكسيلاز و لياز إيزوسيترات.
- Isomerases - تسرع هذه الإنزيمات من تفاعلات الأيزوميرات. هذه هي ردود الفعل التي يتم فيها الاحتفاظ بجميع الذرات الأصلية في المادة المتفاعلة ، ولكن يتم إعادة ترتيبها لتشكيل أيزومرات المتفاعل. الأيزومرات هي جزيئات لها نفس الصيغة الكيميائية ، ولكنها ترتيبات مختلفة. وتشمل الأمثلة إيزوميراز الجلوكوز والفوسفات و Racemase ألانين.
- Ligases - تسمى أيضًا التخليق ، تعزز هذه الإنزيمات معدل انضمام جزيئين. وعادة ما يحققون ذلك من خلال الاستفادة من الطاقة المشتقة من انهيار أدينوزين ثلاثي الفوسفات (ATP). تتضمن أمثلة ligases synthetase acetyl-CoA و DNA ligase.

