Lernziele
In dieser Lektion werden wir lernen
- Was sind Enzyme?
- Hauptmerkmale von Enzymen
- Wie funktionieren Enzyme?
- Schloss- und Schlüsselhypothese
- Induced-Fit-Hypothese
- Schlüsselfaktoren, die die Enzymaktivität beeinflussen
- Sechs verschiedene Arten von Enzymen
WAS SIND ENZYME?
Enzyme sind biologische Katalysatoren, die die chemischen Reaktionen beschleunigen, ohne sich dabei zu verändern. Ein lebendes System steuert seine Aktivität durch Enzyme.
Einige Beispiele für Enzyme sind
- Laktase - Es zerlegt Laktose in Glukose und Galaktose
- Katalase - Es zerlegt Wasserstoffperoxid in Wasser und Sauerstoff
- Glykogensynthase - Sie katalysiert die Bildung glykosidischer Bindungen zwischen Glukosemolekülen
- ATPase - Es zerlegt ATP in ADP und produziert Energie
WAS SIND DIE HAUPTEIGENSCHAFTEN VON ENZYMEN?
- Die Grundfunktion eines Enzyms besteht darin, die Reaktionsgeschwindigkeit zu erhöhen.
- Enzyme sind spezifisch, dh sie haben eine spezifische Form, daher passt nur ein bestimmtes Substrat zu seinem aktiven Zentrum
- Enzyme werden von einem Zustand niedriger Aktivität zu einem Zustand hoher Aktivität und umgekehrt reguliert
WIE FUNKTIONIEREN ENZYME?
Die meisten Reaktionen in einer Zelle erfordern sehr hohe Temperaturen, um in Gang zu kommen, was die Zelle zerstören würde. Enzyme wirken, indem sie die Aktivierungsenergie einer Reaktion senken. Die Aktivierungsenergie einer Reaktion wird verringert, indem die Bindungen innerhalb eines Moleküls belastet werden oder indem Moleküle nahe beieinander gehalten werden. Dies erhöht die Wahrscheinlichkeit einer Reaktion und senkt so die Energie, die erforderlich ist, um sie zu starten.
Das Molekül, an das das Enzym bindet, wird als Substrat bezeichnet. Das Substrat bindet an einen kleinen Abschnitt des Enzyms, der als aktives Zentrum bezeichnet wird. Das am Ende der Reaktion erzeugte Molekül wird als "Produkt" bezeichnet. Sobald die Reaktion abgeschlossen ist, setzt das Enzym das Produkt frei und ist bereit, sich an ein anderes Substrat zu binden.
Es gibt zwei Theorien, um die Enzymwirkung zu erklären
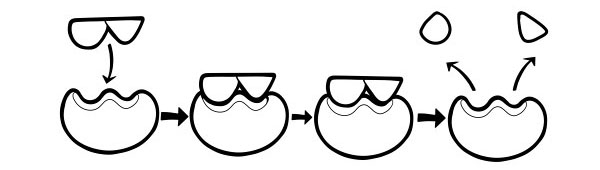
LOCK AND KEY THEORY
Es wurde erstmals 1894 von Emil Fischer postuliert. Die Lock and Key-Hypothese ist ein Modell dafür, wie Enzyme Substratreaktionen katalysieren. Es besagt, dass die Form der aktiven Zentren von Enzymen genau zur Form des Substrats komplementär ist. Wenn ein Substratmolekül mit einem Enzym kollidiert, dessen Form des aktiven Zentrums komplementär ist, passt das Substrat in das aktive Zentrum und es bildet sich ein Enzym-Substrat-Komplex. Das Enzym katalysiert die Reaktion und die Produkte bilden zusammen mit dem Enzym einen Enzym-Produkt-Komplex. Nach diesem Modell kann ein Enzym eine Rückreaktion katalysieren.
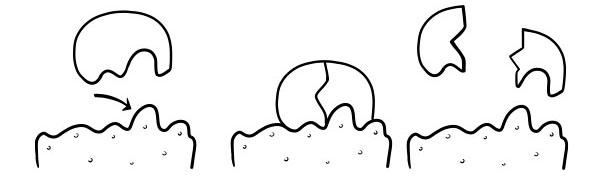
INDUZIERTE HYPOTHESE
Dies ist ein neueres und allgemein anerkanntes Modell zur Beschreibung der Funktionsweise von Enzymen. Es heißt, dass die Form der aktiven Zentren nicht genau komplementär ist, sondern die Form in Gegenwart eines bestimmten Substrats ändert, um komplementär zu werden.
Wenn ein Substratmolekül mit einem Enzym kollidiert und seine Zusammensetzung spezifisch korrekt ist, ändert sich die Form des aktiven Zentrums des Enzyms, so dass das Substrat in sein Enzym passt und sich ein Enzym-Substrat-Komplex bilden kann. Die Reaktion wird dann katalysiert und es bildet sich ein Enzym-Produkt-Komplex.
FAKTOREN, DIE DIE ENZYMAKTIVITÄT BEEINFLUSSEN
Die Umgebung des Enzyms und des Substrats kann die Reaktionsgeschwindigkeit beeinflussen. In einigen Fällen kann die Umgebung dazu führen, dass das Enzym nicht mehr funktioniert oder sich sogar auflöst. Wenn ein Enzym nicht mehr funktioniert, nennen wir es „denaturiert“.
Hier sind einige Faktoren, die die Enzymaktivität beeinflussen können:
- Temperatur - Die Temperatur kann die Reaktionsgeschwindigkeit beeinflussen. Je höher die Temperatur, desto schneller läuft die Reaktion ab. Das Erhöhen oder Verringern der Temperatur außerhalb eines tolerierbaren Bereichs kann jedoch die chemischen Bindungen im aktiven Zentrum beeinflussen, wodurch sie weniger gut zum Binden von Substraten geeignet sind. Sehr hohe Temperaturen können dazu führen, dass ein Enzym denaturiert und seine Form und Aktivität verliert.
- pH - pH kann auch die Enzymfunktion beeinflussen. Aminosäurereste im aktiven Zentrum haben häufig saure oder basische Eigenschaften, die für die Katalyse wichtig sind. Änderungen des pH-Werts können diese Rückstände beeinflussen und die Bindung von Substraten erschweren. Enzyme arbeiten am besten innerhalb eines bestimmten pH-Bereichs, und wie bei der Temperatur können extreme pH-Werte (sauer oder basisch) dazu führen, dass Enzyme denaturieren.
- Die Konzentration von Enzymen und Substrat - Die Reaktionsgeschwindigkeit steigt mit zunehmender Substratkonzentration bis zu einem Punkt, ab dem eine weitere Erhöhung der Substratkonzentration keine signifikante Änderung der Reaktionsgeschwindigkeit bewirkt. Dies tritt auf, weil nach einer bestimmten Konzentration des Substrats alle aktiven Stellen auf dem Enzym voll sind und keine weitere Reaktion stattfinden kann.
- Inhibitoren - Inhibitoren sind Moleküle, die speziell hergestellt wurden, um die Aktivität von Enzymen zu stoppen. Sie können die Reaktion nur verlangsamen oder ganz stoppen. Einige Inhibitoren verbinden sich mit dem Enzym, wodurch es seine Form ändert und nicht richtig funktioniert. Das Gegenteil eines Inhibitors ist ein Aktivator, der helfen kann, die Reaktion zu beschleunigen.
Arten von Enzymen
Der menschliche Körper besteht aus sechs Hauptgruppen oder Klassen von Enzymen:
- Oxidoreduktasen - Diese Enzyme erhöhen die Geschwindigkeit der Oxidations- und Reduktionsreaktionen. Bei diesen Reaktionen, auch Redoxreaktionen genannt, gibt einer der Reaktanten ein Elektronenpaar ab, das ein anderer Reaktant gewinnt. Der Elektronenpaardonor soll oxidiert sein und als Reduktionsmittel wirken, während der reduzierte Elektronenpaarempfänger als Oxidationsmittel bezeichnet wird. Beispiele umfassen Cytochromoxidase und Lactatdehydrogenase.
- Transferasen - Diese Enzyme beschleunigen sich zusammen mit der Übertragung von Gruppen von Atomen wie Methyl (CH 3 ) -, Acetyl (CH 3 CO) - oder Amino (NH 2 ) -Gruppen von einem Molekül auf ein anderes Molekül. Acetatkinase und Alanindeaminase sind Beispiele für Transferasen.
- Hydrolasen - Diese Enzyme beschleunigen Hydrolysereaktionen. Hydrolysereaktionen verwenden Wasser (H 2 O), um eine Bindung in einem Molekül zu spalten und zwei Tochterprodukte zu erzeugen, üblicherweise durch Anbringen des -OH (Hydroxylgruppe) aus dem Wasser an eines der Produkte und eines einzelnen -H (Wasserstoffatom) an das andere. In der Zwischenzeit wird aus den durch die -H- und -OH-Komponenten verdrängten Atomen ein neues Molekül gebildet. Die Verdauungsenzyme Lipase und Sucrase sind Hydrolasen.
- Lyasen - Diese Enzyme erhöhen die Geschwindigkeit der Addition einer Molekülgruppe an eine Doppelbindung oder die Entfernung von zwei Gruppen aus nahe gelegenen Atomen, um eine Doppelbindung zu erzeugen. Diese wirken wie Hydrolasen, außer dass die entfernte Komponente nicht durch Wasser oder Teile von Wasser verdrängt wird. Diese Klasse von Enzymen umfasst Oxalatdecarboxylase und Isocitratlyase.
- Isomerasen - Diese Enzyme beschleunigen Isomerisierungsreaktionen. Dies sind Reaktionen, bei denen alle ursprünglichen Atome im Reaktanten erhalten bleiben, aber neu angeordnet werden, um ein Isomer des Reaktanten zu bilden. Isomere sind Moleküle mit der gleichen chemischen Formel, aber unterschiedlichen Anordnungen. Beispiele umfassen Glucose-Phosphat-Isomerase und Alanin-Racemase.
- Ligasen - Diese Enzyme werden auch als Synthetasen bezeichnet und erhöhen die Verbindungsrate zweier Moleküle. Sie erreichen dies normalerweise, indem sie Energie nutzen, die aus dem Abbau von Adenosintriphosphat (ATP) stammt. Beispiele für Ligasen umfassen Acetyl-CoA-Synthetase und DNA-Ligase.

