Objetivos de aprendizaje
En esta lección, aprenderemos
- ¿Qué son las enzimas?
- Principales características de las enzimas.
- ¿Cómo funcionan las enzimas?
- Hipótesis de cerradura y llave
- Hipótesis de ajuste inducido
- Factores clave que afectan la actividad enzimática.
- Seis tipos diferentes de enzimas
¿Qué son las enzimas?
Las enzimas son catalizadores biológicos que aceleran las reacciones químicas sin que se alteren en el proceso. Un sistema vivo controla su actividad a través de enzimas.
Algunos ejemplos de enzimas son
- Lactasa: descompone la lactosa en glucosa y galactosa
- Catalasa: descompone el peróxido de hidrógeno en agua y oxígeno
- Glucógeno sintasa: cataliza la formación de enlaces glucosídicos entre las moléculas de glucosa.
- ATPase: descompone el ATP en ADP, produciendo energía
¿CUÁLES SON LAS PRINCIPALES CARACTERÍSTICAS DE LAS ENZIMAS?
- La función básica de una enzima es aumentar la velocidad de una reacción.
- Las enzimas son específicas, es decir, tienen una forma específica, por lo tanto, solo un determinado sustrato se ajustará a su sitio activo
- Las enzimas están reguladas de un estado de baja actividad a alta actividad y viceversa.
¿CÓMO FUNCIONAN LAS ENZIMAS?
La mayoría de las reacciones en una célula requieren temperaturas muy altas para funcionar, lo que destruiría la célula. Las enzimas funcionan disminuyendo la energía de activación de una reacción. La energía de activación de una reacción se reduce al ejercer presión sobre los enlaces dentro de una molécula, o al mantener las moléculas juntas. Esto aumenta la probabilidad de una reacción y disminuye la energía requerida para comenzar.
La molécula con la que se une la enzima se denomina sustrato. El sustrato se une a una pequeña sección de la enzima denominada sitio activo. La molécula producida al final de la reacción se llama 'producto'. Una vez que se completa la reacción, la enzima libera el producto y está lista para unirse con otro sustrato.
Hay dos teorías para explicar la acción enzimática.
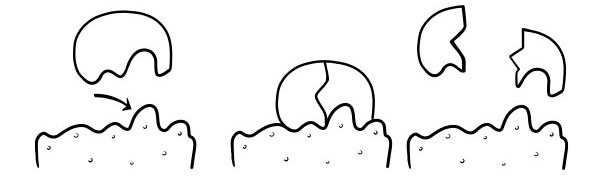
BLOQUEO Y TEORÍA CLAVE
Fue postulado por primera vez en 1894 por Emil Fischer. La hipótesis de bloqueo y clave es un modelo de cómo las enzimas catalizan las reacciones del sustrato. Establece que la forma de los sitios activos de las enzimas es exactamente complementaria a la forma del sustrato. Cuando una molécula de sustrato colisiona con una enzima cuya forma del sitio activo es complementaria, el sustrato se ajustará al sitio activo y se formará un complejo enzima-sustrato. La enzima catalizará la reacción, y los productos, junto con la enzima, formarán un complejo enzima-producto. Según este modelo, es posible que una enzima catalice una reacción inversa.
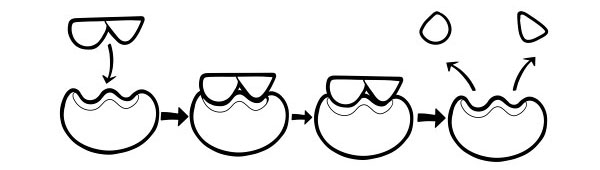
Hipótesis de ajuste inducido
Este es un modelo más reciente y ampliamente aceptado para describir la forma en que funcionan las enzimas. Establece que la forma de los sitios activos no es exactamente complementaria, sino que cambia de forma en presencia de un sustrato específico para convertirse en complementaria.
Cuando una molécula de sustrato colisiona con una enzima, si su composición es específicamente correcta, la forma del sitio activo de la enzima cambiará de manera que el sustrato se ajuste a ella y se pueda formar un complejo enzima-sustrato. Luego se cataliza la reacción y se forma una compleja enzima-producto.
FACTORES QUE AFECTAN LA ACTIVIDAD DE ENZIMA
El entorno de la enzima y el sustrato puede afectar la velocidad de la reacción. En algunos casos, el entorno puede hacer que la enzima deje de funcionar o incluso se desenrede. Cuando una enzima deja de funcionar, la llamamos "desnaturalizada".
Estos son algunos factores que pueden afectar la actividad enzimática:
- Temperatura : la temperatura puede afectar la velocidad de reacción. Cuanto mayor sea la temperatura, más rápido se producirá la reacción. Sin embargo, aumentar o disminuir la temperatura fuera de un rango tolerable puede afectar los enlaces químicos en el sitio activo, haciéndolos menos adecuados para unir sustratos. Las temperaturas muy altas pueden causar que una enzima se desnaturalice, perdiendo su forma y actividad.
- pH : el pH también puede afectar la función enzimática. Los residuos de aminoácidos del sitio activo a menudo tienen propiedades ácidas o básicas que son importantes para la catálisis. Los cambios en el pH pueden afectar estos residuos y dificultar la unión de los sustratos. Las enzimas funcionan mejor dentro de un cierto rango de pH, y al igual que con la temperatura, los valores de pH extremos (ácidos o básicos) pueden hacer que las enzimas se desnaturalicen.
- La concentración de enzimas y sustrato : la velocidad de reacción aumenta al aumentar la concentración de sustrato hasta un punto, más allá del cual cualquier aumento adicional en la concentración de sustrato no produce cambios significativos en la velocidad de reacción. Esto ocurre porque después de una cierta concentración del sustrato, todos los sitios activos en la enzima están llenos y no puede producirse más reacción.
- Inhibidores : los inhibidores son moléculas que están hechas especialmente para detener la actividad de las enzimas. Pueden ralentizar la reacción o detenerla por completo. Algunos inhibidores se unen con la enzima haciendo que cambie de forma y no funcione correctamente. Lo contrario de un inhibidor es un activador que puede ayudar a acelerar la reacción.
TIPOS DE ENZIMAS
El cuerpo humano consta de seis grupos principales o clases de enzimas:
- Oxidorreductasas : estas enzimas mejoran la velocidad de oxidación y las reacciones de reducción. En estas reacciones, también llamadas reacciones redox, uno de los reactivos cede un par de electrones que gana otro reactivo. Se dice que el donante de pares de electrones se oxida y actúa como un agente reductor, mientras que el receptor de pares de electrones se reduce se llama agente oxidante. Los ejemplos incluyen citocromo oxidasa y lactato deshidrogenasa.
- Transferasas : estas enzimas se aceleran junto con la transferencia de grupos de átomos, como los grupos metilo (CH 3 ), acetilo (CH 3 CO) o amino (NH 2 ), de una molécula a otra. La acetato quinasa y la alanina desaminasa son ejemplos de transferasas.
- Hidrolasas : estas enzimas aceleran las reacciones de hidrólisis. Las reacciones de hidrólisis uso del agua (H 2 O) para dividir un enlace en una molécula para crear dos productos hija, por lo general mediante la colocación de la -OH (grupo hidroxilo) del agua a uno de los productos y una sola -H (átomo de hidrógeno) a el otro. Mientras tanto, se forma una nueva molécula a partir de los átomos desplazados por los componentes -H y -OH. Las enzimas digestivas lipasa y sacarasa son hidrolasas.
- Liasas : estas enzimas mejoran la velocidad de la adición de un grupo molecular a un doble enlace o la eliminación de dos grupos de átomos cercanos para crear un doble enlace. Estos actúan como hidrolasas, excepto que el componente eliminado no es desplazado por el agua o porciones de agua. Esta clase de enzimas incluyen oxalato descarboxilasa e isocitrato liasa.
- Isomerasas : estas enzimas aceleran las reacciones de isomerización. Estas son reacciones en las que todos los átomos originales en el reactivo se retienen, pero se reorganizan para formar un isómero del reactivo. Los isómeros son moléculas con la misma fórmula química, pero con diferentes disposiciones. Los ejemplos incluyen glucosa-fosfato isomerasa y alanina racemasa.
- Ligases : también llamadas sintetasas, estas enzimas mejoran la velocidad de unión de dos moléculas. Por lo general, logran esto mediante el uso de energía derivada de la descomposición del trifosfato de adenosina (ATP). Ejemplos de ligasas incluyen acetil-CoA sintetasa y ADN ligasa.

