اهداف یادگیری
در این درس یاد خواهیم گرفت
- آنزیم ها چیست؟
- ویژگی های اصلی آنزیم ها
- آنزیم ها چگونه کار می کنند؟
- فرضیه قفل و کلید
- فرضیه برازش القایی
- عوامل کلیدی که بر فعالیت آنزیم تأثیر می گذارد
- شش نوع مختلف آنزیم
آنزیم ها چه هستند؟
آنزیمها کاتالیزورهای بیولوژیکی هستند که واکنشهای شیمیایی را بدون تغییر در فرآیند سرعت میبخشند. یک سیستم زنده فعالیت خود را از طریق آنزیم ها کنترل می کند.
چند نمونه از آنزیم ها هستند
- لاکتاز - لاکتوز را به گلوکز و گالاکتوز تجزیه می کند
- کاتالاز - پراکسید هیدروژن را به آب و اکسیژن تجزیه می کند
- گلیکوژن سنتاز - تشکیل پیوندهای گلیکوزیدی بین مولکول های گلوکز را کاتالیز می کند.
- ATPase - ATP را به ADP تجزیه می کند و انرژی تولید می کند
ویژگی های اصلی آنزیم ها چیست؟
- وظیفه اصلی آنزیم افزایش سرعت واکنش است.
- آنزیم ها خاص هستند، یعنی شکل خاصی دارند، بنابراین فقط یک بستر خاص در محل فعال آن قرار می گیرد
- آنزیم ها از حالت فعالیت کم به فعالیت زیاد و بالعکس تنظیم می شوند
آنزیم ها چگونه کار می کنند؟
اکثر واکنشها در یک سلول برای شروع به دمای بسیار بالا نیاز دارند که باعث نابودی سلول میشود. آنزیم ها با کاهش انرژی فعال سازی یک واکنش کار می کنند. انرژی فعالسازی یک واکنش با وارد کردن فشار به پیوندهای درون یک مولکول یا با نزدیک نگه داشتن مولکولها به هم کاهش مییابد. این احتمال واکنش را افزایش می دهد و بنابراین انرژی لازم برای شروع آن را کاهش می دهد.
به مولکولی که آنزیم با آن متصل می شود، سوبسترا می گویند. سوبسترا به بخش کوچکی از آنزیم که محل فعال نامیده می شود متصل می شود. به مولکولی که در پایان واکنش تولید می شود «محصول» می گویند. هنگامی که واکنش کامل شد، آنزیم محصول را آزاد می کند و آماده اتصال به بستر دیگری است.
دو نظریه برای توضیح عملکرد آنزیم وجود دارد
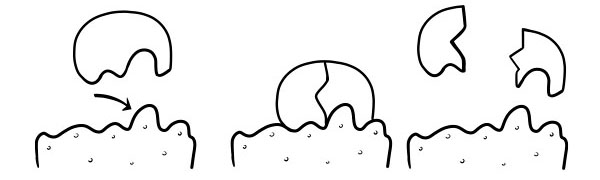
نظریه قفل و کلید
اولین بار در سال 1894 توسط امیل فیشر مطرح شد. فرضیه قفل و کلید مدلی از چگونگی واکنش آنزیمها به سوبسترا است. بیان می کند که شکل مکان های فعال آنزیم ها دقیقاً مکمل شکل بستر است. هنگامی که یک مولکول سوبسترا با آنزیمی برخورد می کند که شکل مکان فعال آن مکمل یکدیگر است، بستر در محل فعال قرار می گیرد و یک کمپلکس آنزیم- بستر تشکیل می شود. آنزیم واکنش را کاتالیز می کند و محصولات به همراه آنزیم یک کمپلکس آنزیم-محصول را تشکیل می دهند. بر اساس این مدل، ممکن است یک آنزیم یک واکنش معکوس را کاتالیز کند.
فرضیه برازش القایی
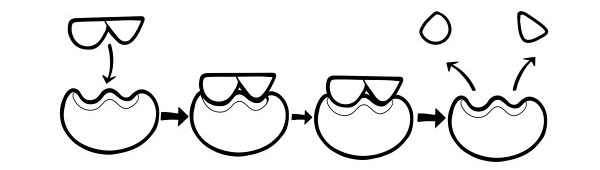
این یک مدل جدیدتر و به طور گسترده پذیرفته شده برای توصیف نحوه عملکرد آنزیم ها است. بیان میکند که شکل مکانهای فعال دقیقا مکمل هم نیستند، اما در حضور یک بستر خاص، شکلشان را تغییر میدهند تا مکمل شوند.
هنگامی که یک مولکول سوبسترا با یک آنزیم برخورد می کند، اگر ترکیب آن به طور خاص درست باشد، شکل محل فعال آنزیم تغییر می کند به طوری که بستر در آن قرار می گیرد و یک کمپلکس آنزیم- سوبسترا می تواند تشکیل شود. سپس واکنش کاتالیز می شود و یک کمپلکس آنزیم-محصول تشکیل می شود.
عواملی که بر فعالیت آنزیم تأثیر می گذارد
محیط آنزیم و سوبسترا می تواند بر سرعت واکنش تأثیر بگذارد. در برخی موارد، محیط می تواند باعث از کار افتادن آنزیم یا حتی از بین رفتن آن شود. هنگامی که یک آنزیم از کار می افتد، آن را «دناتوره شده» می نامیم.
در اینجا برخی از عواملی که می توانند بر فعالیت آنزیم تأثیر بگذارند آورده شده است:
- دما - دما می تواند بر سرعت واکنش تأثیر بگذارد. هر چه دما بالاتر باشد، واکنش سریعتر رخ خواهد داد. با این حال، افزایش یا کاهش دما در خارج از محدوده قابل تحمل می تواند بر پیوندهای شیمیایی در محل فعال تأثیر بگذارد و آنها را برای اتصال بسترها مناسب تر کند. دمای بسیار بالا ممکن است باعث دناتوره شدن آنزیم شود و شکل و فعالیت خود را از دست بدهد.
- pH - pH همچنین می تواند بر عملکرد آنزیم تأثیر بگذارد. باقی مانده های اسید آمینه محل فعال اغلب دارای خواص اسیدی یا بازی هستند که برای کاتالیز مهم هستند. تغییرات pH می تواند بر این باقیمانده ها تأثیر بگذارد و اتصال بسترها را سخت کند. آنزیم ها در محدوده PH مشخصی بهترین عملکرد را دارند و مانند دما، مقادیر شدید pH (اسیدی یا بازی) می تواند آنزیم ها را دناتوره کند.
- غلظت آنزیم ها و سوبسترا - سرعت واکنش با افزایش غلظت سوبسترا تا یک نقطه افزایش می یابد که فراتر از آن افزایش بیشتر در غلظت سوبسترا تغییر قابل توجهی در سرعت واکنش ایجاد نمی کند. این امر به این دلیل اتفاق می افتد که پس از غلظت معینی از سوبسترا، تمام نقاط فعال آنزیم پر شده و هیچ واکنش دیگری نمی تواند رخ دهد.
- مهارکننده ها - مهارکننده ها مولکول هایی هستند که به طور خاص برای متوقف کردن فعالیت آنزیم ها ساخته شده اند. آنها فقط ممکن است واکنش را کاهش دهند یا آن را به طور کامل متوقف کنند. برخی از مهارکننده ها با آنزیم پیوند می خورند و باعث تغییر شکل آن و عدم عملکرد صحیح آن می شوند. نقطه مقابل مهارکننده، فعال کننده ای است که می تواند به تسریع واکنش کمک کند.
انواع آنزیم ها
بدن انسان از شش گروه یا کلاس اصلی آنزیم تشکیل شده است:
- اکسیدرودوکتازها - این آنزیم ها سرعت واکنش های اکسیداسیون و کاهش را افزایش می دهند. در این واکنشها که واکنشهای ردوکس نیز نامیده میشوند، یکی از واکنشدهندهها یک جفت الکترون میدهد که واکنشدهنده دیگری به دست میآورد. گفته می شود که دهنده جفت الکترون اکسید شده است و به عنوان یک عامل احیا کننده عمل می کند، در حالی که گیرنده جفت الکترون کاهش می یابد، عامل اکسید کننده نامیده می شود. به عنوان مثال می توان به سیتوکروم اکسیداز و لاکتات دهیدروژناز اشاره کرد.
- ترانسفرازها – این آنزیم ها همراه با انتقال گروه هایی از اتم ها، مانند گروه های متیل (CH 3 )، استیل (CH 3 CO) یا آمینو (NH 2 ) از یک مولکول به مولکول دیگر سرعت می گیرند. استات کیناز و آلانین دآمیناز نمونه هایی از ترانسفرازها هستند.
- هیدرولازها - این آنزیم ها واکنش های هیدرولیز را تسریع می کنند. در واکنشهای هیدرولیز از آب ( H2O ) برای شکافتن پیوند در یک مولکول برای ایجاد دو محصول دختر استفاده میشود که معمولاً با چسباندن -OH (گروه هیدروکسیل) از آب به یکی از محصولات و یک -H (اتم هیدروژن) دیگری. در این بین، یک مولکول جدید از اتم های جابجا شده توسط اجزای -H و -OH تشکیل می شود. آنزیم های گوارشی لیپاز و ساکاراز هیدرولاز هستند.
- لیازها - این آنزیم ها سرعت افزودن یک گروه مولکولی به یک پیوند دوگانه یا حذف دو گروه از اتم های مجاور را برای ایجاد یک پیوند دوگانه افزایش می دهند. اینها مانند هیدرولاز عمل می کنند، با این تفاوت که جزء حذف شده توسط آب یا بخش هایی از آب جابجا نمی شود. این دسته از آنزیم ها شامل اگزالات دکربوکسیلاز و ایزوسیترات لیاز هستند.
- ایزومرازها - این آنزیم ها واکنش های ایزومریزاسیون را سرعت می بخشند. اینها واکنش هایی هستند که در آنها تمام اتم های اصلی در واکنش دهنده حفظ می شوند، اما برای تشکیل یک ایزومر از واکنش دهنده بازآرایی می شوند. ایزومرها مولکول هایی با فرمول شیمیایی یکسان، اما آرایش متفاوت هستند. به عنوان مثال می توان به گلوکز-فسفات ایزومراز و آلانین راسماز اشاره کرد.
- لیگازها - که سنتتازها نیز نامیده می شوند، این آنزیم ها سرعت اتصال دو مولکول را افزایش می دهند. آنها معمولاً این کار را با استفاده از انرژی حاصل از تجزیه آدنوزین تری فسفات (ATP) انجام می دهند. نمونه هایی از لیگازها عبارتند از استیل کوآ سنتتاز و DNA لیگاز.

