Objectifs d'apprentissage
Dans cette leçon, nous allons apprendre
- Que sont les enzymes?
- Principales caractéristiques des enzymes
- Comment fonctionnent les enzymes?
- Hypothèse de verrouillage et de clé
- Hypothèse d'ajustement induit
- Facteurs clés qui affectent l'activité enzymatique
- Six types différents d'enzymes
QUE SONT LES ENZYMES?
Les enzymes sont des catalyseurs biologiques qui accélèrent les réactions chimiques sans se modifier elles-mêmes au cours du processus. Un système vivant contrôle son activité grâce à des enzymes.
Quelques exemples d'enzymes sont
- Lactase - Il décompose le lactose en glucose et galactose
- Catalase - Il décompose le peroxyde d'hydrogène en eau et en oxygène
- Glycogène synthase - Il catalyse la formation de liaisons glycosidiques entre les molécules de glucose
- ATPase - Il décompose l'ATP en ADP, produisant de l'énergie
QUELLES SONT LES PRINCIPALES CARACTÉRISTIQUES DES ENZYMES?
- La fonction de base d'une enzyme est d'augmenter la vitesse d'une réaction.
- Les enzymes sont spécifiques, c'est-à-dire qu'elles ont une forme spécifique, donc seul un certain substrat s'adaptera à son site actif
- Les enzymes sont régulées d'un état de faible activité à une activité élevée et vice versa
COMMENT FONCTIONNENT LES ENZYMES?
La plupart des réactions dans une cellule nécessitent des températures très élevées pour se déclencher, ce qui détruirait la cellule. Les enzymes agissent en abaissant l'énergie d'activation d'une réaction. L'énergie d'activation d'une réaction est abaissée en mettant l'accent sur les liaisons au sein d'une molécule ou en maintenant les molécules proches les unes des autres. Cela augmente la probabilité d'une réaction et réduit ainsi l'énergie nécessaire pour la déclencher.
La molécule avec laquelle l'enzyme se lie est appelée substrat. Le substrat se lie à une petite section de l'enzyme appelée site actif. La molécule produite à la fin de la réaction est appelée «produit». Une fois la réaction terminée, l'enzyme libère le produit et est prête à se lier à un autre substrat.
Il existe deux théories pour expliquer l'action enzymatique
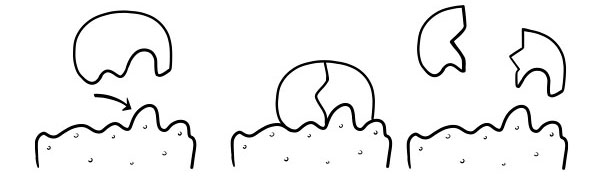
THÉORIE DES SERRURES ET DES CLÉS
Il a été postulé pour la première fois en 1894 par Emil Fischer. L'hypothèse Lock and Key est un modèle de la façon dont les enzymes catalysent les réactions du substrat. Il indique que la forme des sites actifs des enzymes est exactement complémentaire de la forme du substrat. Lorsqu'une molécule substrat entre en collision avec une enzyme dont la forme du site actif est complémentaire, le substrat s'insère dans le site actif et un complexe enzyme-substrat se forme. L'enzyme catalysera la réaction et les produits, avec l'enzyme formeront un complexe enzyme-produit. Selon ce modèle, il est possible pour une enzyme de catalyser une réaction inverse.
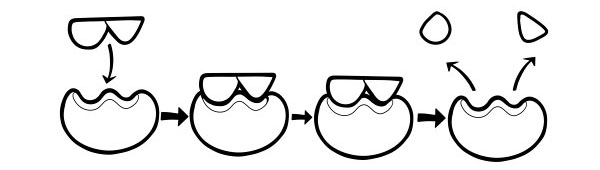
HYPOTHÈSE INDUITE
Il s'agit d'un modèle plus récent et largement accepté pour décrire le fonctionnement des enzymes. Il précise que la forme des sites actifs n'est pas exactement complémentaire mais change de forme en présence d'un substrat spécifique pour devenir complémentaire.
Lorsqu'une molécule de substrat entre en collision avec une enzyme, si sa composition est spécifiquement correcte, la forme du site actif de l'enzyme changera de sorte que le substrat s'insère dans le sien et qu'un complexe enzyme-substrat puisse se former. La réaction est ensuite catalysée et un complexe enzyme-produit se forme.
FACTEURS QUI AFFECTENT L'ACTIVITÉ ENZYME
L'environnement de l'enzyme et du substrat peut affecter la vitesse de la réaction. Dans certains cas, l'environnement peut empêcher l'enzyme de fonctionner ou même se défaire. Lorsqu'une enzyme cesse de fonctionner, nous l'appelons «dénaturée».
Voici quelques facteurs qui peuvent affecter l'activité enzymatique:
- Température - La température peut affecter la vitesse de réaction. Plus la température est élevée, plus la réaction se produira rapidement. Cependant, l'augmentation ou la diminution de la température en dehors d'une plage tolérable peut affecter les liaisons chimiques dans le site actif, les rendant moins bien adaptées pour lier des substrats. Des températures très élevées peuvent entraîner la dénaturation d'une enzyme, perdant sa forme et son activité.
- pH - le pH peut également affecter la fonction enzymatique. Les résidus d'acides aminés du site actif ont souvent des propriétés acides ou basiques qui sont importantes pour la catalyse. Les changements de pH peuvent affecter ces résidus et rendre difficile la liaison des substrats. Les enzymes fonctionnent mieux dans une certaine plage de pH et, comme pour la température, des valeurs de pH extrêmes (acides ou basiques) peuvent dénaturer les enzymes.
- La concentration des enzymes et du substrat - La vitesse de réaction augmente avec l'augmentation de la concentration du substrat jusqu'à un point, au-delà duquel toute augmentation supplémentaire de la concentration du substrat ne produit aucun changement significatif de la vitesse de réaction. Cela se produit car après une certaine concentration du substrat, tous les sites actifs de l'enzyme sont pleins et aucune autre réaction ne peut se produire.
- Inhibiteurs - Les inhibiteurs sont des molécules spécialement conçues pour arrêter l'activité des enzymes. Ils peuvent simplement ralentir la réaction ou l'arrêter complètement. Certains inhibiteurs se lient à l'enzyme, la faisant changer de forme et ne pas fonctionner correctement. Le contraire d'un inhibiteur est un activateur qui peut aider à accélérer la réaction.
TYPES D'ENZYMES
Le corps humain se compose de six grands groupes ou classes d'enzymes:
- Oxydoréductases - Ces enzymes améliorent la vitesse des réactions d'oxydation et de réduction. Dans ces réactions, également appelées réactions redox, l'un des réactifs cède une paire d'électrons qu'un autre réactif gagne. On dit que le donneur de paires d'électrons est oxydé et agit comme un agent réducteur, tandis que le receveur de paires d'électrons est réduit est appelé l'agent oxydant. Les exemples incluent la cytochrome oxydase et la lactate déshydrogénase.
- Transferases - Ces enzymes accélèrent le transfert de groupes d'atomes, tels que les groupes méthyle (CH 3 ), acétyle (CH 3 CO) ou amino (NH 2 ), d'une molécule à une autre molécule. L'acétate kinase et l'alanine désaminase sont des exemples de transférases.
- Hydrolases - Ces enzymes accélèrent les réactions d'hydrolyse. Les réactions d'hydrolyse utilisent de l'eau (H 2 O) pour scinder une liaison dans une molécule pour créer deux produits filles, généralement en fixant le -OH (groupe hydroxyle) de l'eau à l'un des produits et un seul -H (atome d'hydrogène) à L'autre. Dans l'intervalle, une nouvelle molécule est formée à partir des atomes déplacés par les composants -H et -OH. Les enzymes digestives lipase et sucrase sont des hydrolases.
- Lyases - Ces enzymes améliorent la vitesse d'addition d'un groupe moléculaire à une double liaison ou l'élimination de deux groupes d'atomes voisins pour créer une double liaison. Celles-ci agissent comme des hydrolases, sauf que le composant éliminé n'est pas déplacé par l'eau ou des portions d'eau. Cette classe d'enzymes comprend l'oxalate décarboxylase et l'isocitrate lyase.
- Isomérases - Ces enzymes accélèrent les réactions d'isomérisation. Ce sont des réactions dans lesquelles tous les atomes d'origine du réactif sont conservés, mais sont réarrangés pour former un isomère du réactif. Les isomères sont des molécules ayant la même formule chimique, mais des arrangements différents. Des exemples comprennent la glucose-phosphate isomérase et l'alanine racémase.
- Ligases - Aussi appelées synthétases, ces enzymes améliorent la vitesse de jonction de deux molécules. Ils accomplissent généralement cela en utilisant l'énergie dérivée de la dégradation de l'adénosine triphosphate (ATP). Des exemples de ligases comprennent l'acétyl-CoA synthétase et l'ADN ligase.

