ciljevi učenja
U ovoj lekciji ćemo naučiti
- Što su enzimi?
- Glavne karakteristike enzima
- Kako djeluju enzimi?
- Hipoteza brave i ključa
- Hipoteza induciranog uklapanja
- Ključni čimbenici koji utječu na aktivnost enzima
- Šest različitih vrsta enzima
ŠTO SU ENZIMI?
Enzimi su biološki katalizatori koji ubrzavaju kemijske reakcije, a da se pritom ne mijenjaju. Živi sustav kontrolira svoju aktivnost putem enzima.
Neki primjeri enzima su
- Laktaza – razlaže laktozu na glukozu i galaktozu
- Katalaza – razlaže vodikov peroksid na vodu i kisik
- Glikogen sintaza – katalizira stvaranje glikozidnih veza između molekula glukoze
- ATPaza – razgrađuje ATP u ADP, proizvodeći energiju
KOJE SU GLAVNE KARAKTERISTIKE ENZIMA?
- Osnovna funkcija enzima je povećati brzinu reakcije.
- Enzimi su specifični, odnosno imaju specifičan oblik, pa će samo određeni supstrat odgovarati njegovom aktivnom mjestu
- Enzimi se reguliraju od stanja niske aktivnosti do visoke aktivnosti i obrnuto
KAKO DELUJU ENZIMI?
Većina reakcija u stanici zahtijeva vrlo visoke temperature da bi se pokrenule, što bi uništilo stanicu. Enzimi djeluju tako što smanjuju aktivacijsku energiju reakcije. Energija aktivacije reakcije smanjuje se stavljanjem stresa na veze unutar molekule ili držanjem molekula blizu jedne. To povećava vjerojatnost reakcije i tako smanjuje energiju potrebnu za njezin početak.
Molekula s kojom se enzim veže naziva se supstratom. Supstrat se veže na mali dio enzima koji se naziva aktivno mjesto. Molekula nastala na kraju reakcije naziva se 'proizvod'. Kada se reakcija završi, enzim oslobađa produkt i spreman je za vezanje s drugim supstratom.
Postoje dvije teorije koje objašnjavaju djelovanje enzima
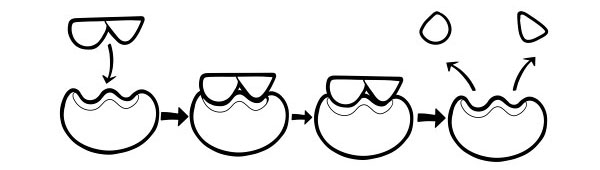
TEORIJA BRAVA I KLJUČA
Prvi ga je postulirao Emil Fischer 1894. godine. Hipoteza brave i ključa je model kako enzimi katalizator supstratnih reakcija. Navodi da je oblik aktivnih mjesta enzima točno komplementaran obliku supstrata. Kada se molekula supstrata sudari s enzimom čiji je oblik aktivnog mjesta komplementaran, supstrat će se uklopiti u aktivno mjesto i formirat će se kompleks enzim-supstrat. Enzim će katalizirati reakciju, a proizvodi će zajedno s enzimom tvoriti kompleks enzim-proizvod. Prema ovom modelu, moguće je da enzim katalizira obrnutu reakciju.
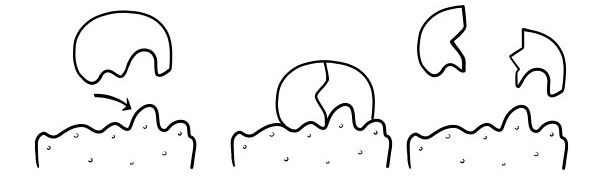
HIPOTEZA INDUCIRANOG PRILAGOĐENJA
Ovo je noviji i široko prihvaćen model za opisivanje načina na koji enzimi rade. Navodi da oblik aktivnih mjesta nije baš komplementaran, već mijenja oblik u prisutnosti specifičnog supstrata kako bi postao komplementaran.
Kada se molekula supstrata sudari s enzimom, ako je njegov sastav točno ispravan, oblik aktivnog mjesta enzima će se promijeniti tako da se supstrat uklapa u enzim i može nastati kompleks enzim-supstrat. Reakcija se zatim katalizira i formira se kompleks enzim-proizvod.
ČIMBENICI KOJI UTJEČU NA AKTIVNOST ENZIMA
Okolina enzima i supstrata mogu utjecati na brzinu reakcije. U nekim slučajevima, okolina može uzrokovati prestanak rada enzima ili čak rasplet. Kada enzim prestane raditi, nazivamo ga "denaturiranim".
Evo nekoliko čimbenika koji mogu utjecati na aktivnost enzima:
- Temperatura – Temperatura može utjecati na brzinu reakcije. Što je temperatura viša, reakcija će se dogoditi brže. Međutim, bilo povećanje ili smanjenje temperature izvan podnošljivog raspona može utjecati na kemijske veze u aktivnom mjestu, čineći ih manje prikladnim za vezanje supstrata. Vrlo visoke temperature mogu uzrokovati denaturaciju enzima, gubeći svoj oblik i aktivnost.
- pH – pH također može utjecati na funkciju enzima. Aminokiselinski ostaci aktivnog mjesta često imaju kisela ili bazična svojstva koja su važna za katalizu. Promjene u pH mogu utjecati na te ostatke i otežati vezivanje supstrata. Enzimi najbolje djeluju unutar određenog pH raspona, a kao i kod temperature, ekstremne pH vrijednosti (kiseline ili bazične) mogu dovesti do denaturacije enzima.
- Koncentracija enzima i supstrata – Brzina reakcije raste s povećanjem koncentracije supstrata do točke, nakon koje bilo kakvo daljnje povećanje koncentracije supstrata ne proizvodi značajnu promjenu brzine reakcije. To se događa jer su nakon određene koncentracije supstrata sva aktivna mjesta na enzimu puna i ne može doći do daljnje reakcije.
- Inhibitori – Inhibitori su molekule koje su posebno napravljene da zaustave aktivnost enzima. Oni mogu samo usporiti reakciju ili je potpuno zaustaviti. Neki inhibitori se vežu s enzimom uzrokujući da promijeni oblik i ne radi ispravno. Suprotnost inhibitoru je aktivator koji može pomoći u ubrzavanju reakcije.
VRSTE ENZIMA
Ljudsko tijelo sastoji se od šest glavnih skupina ili klasa enzima:
- Oksidoreduktaze – Ovi enzimi povećavaju brzinu oksidacijskih i redukcijskih reakcija. U tim reakcijama, koje se također nazivaju redoks reakcijama, jedan od reaktanata daje par elektrona koje drugi reaktant dobije. Kaže se da je donor elektronskog para oksidiran i djeluje kao redukcijsko sredstvo, dok se primatelj elektronskog para reducira naziva oksidacijskim sredstvom. Primjeri uključuju citokrom oksidazu i laktat dehidrogenazu.
- Transferaze – Ovi enzimi ubrzavaju zajedno s prijenosom skupina atoma, kao što su metil (CH 3 ), acetil (CH 3 CO) ili amino (NH 2 ) skupine, s jedne molekule na drugu molekulu. Acetat kinaza i alanin deaminaza su primjeri transferaza.
- Hidrolaze – Ovi enzimi ubrzavaju reakcije hidrolize. Reakcije hidrolize koriste vodu (H 2 O) za cijepanje veze u molekuli kako bi se stvorila dva produkta kćer, obično pričvršćivanjem -OH (hidroksilne skupine) iz vode na jedan od proizvoda i jednog -H (atoma vodika) na drugi. U međuvremenu, nova molekula nastaje od atoma istisnutih komponentama -H i -OH. Probavni enzimi lipaza i saharaza su hidrolaze.
- Liaze – Ovi enzimi povećavaju brzinu dodavanja jedne molekularne skupine na dvostruku vezu ili uklanjanje dviju skupina iz obližnjih atoma kako bi se stvorila dvostruka veza. One djeluju poput hidrolaze, osim što uklonjena komponenta nije istisnuta vodom ili dijelovima vode. Ova klasa enzima uključuje oksalat dekarboksilazu i izocitrat liazu.
- Izomeraze – Ovi enzimi ubrzavaju reakcije izomerizacije. To su reakcije u kojima se zadržavaju svi izvorni atomi u reaktantu, ali su preuređeni da tvore izomer reaktanta. Izomeri su molekule s istom kemijskom formulom, ali različitog rasporeda. Primjeri uključuju glukoza-fosfat izomerazu i alanin racemazu.
- Ligaze – Nazivaju se i sintetaze, ovi enzimi povećavaju brzinu spajanja dviju molekula. Oni to obično postižu korištenjem energije dobivene razgradnjom adenozin trifosfata (ATP). Primjeri ligaza uključuju acetil-CoA sintetazu i DNA ligazu.

