Tujuan pembelajaran
Dalam pelajaran ini, kita akan belajar
- Apa itu enzim?
- Sifat utama enzim
- Bagaimana cara kerja enzim?
- Hipotesis Gembok dan Kunci
- Hipotesis Induced-Fit
- Faktor kunci yang mempengaruhi aktivitas enzim
- Enam jenis enzim yang berbeda
APA ITU ENZIM?
Enzim adalah katalis biologis yang mempercepat reaksi kimia tanpa mengubah dirinya sendiri dalam prosesnya. Sebuah sistem hidup mengontrol aktivitasnya melalui enzim.
Beberapa contoh enzim adalah
- Laktase - Ini memecah Laktosa menjadi Glukosa dan Galaktosa
- Katalase – Ini memecah hidrogen peroksida menjadi air dan oksigen
- Glikogen sintase – Ini mengkatalisis pembentukan ikatan glikosidik antara molekul glukosa
- ATPase – Ini memecah ATP menjadi ADP, menghasilkan energi
APA KARAKTERISTIK UTAMA ENZIM?
- Fungsi dasar enzim adalah untuk meningkatkan laju reaksi.
- Enzim spesifik yaitu mereka memiliki bentuk tertentu, oleh karena itu hanya substrat tertentu yang sesuai dengan situs aktifnya
- Enzim diatur dari keadaan aktivitas rendah ke aktivitas tinggi dan sebaliknya
BAGAIMANA CARA KERJA ENZIM?
Sebagian besar reaksi dalam sel membutuhkan suhu yang sangat tinggi untuk memulainya, yang akan menghancurkan sel. Enzim bekerja dengan cara menurunkan energi aktivasi suatu reaksi. Energi aktivasi suatu reaksi diturunkan dengan memberi tekanan pada ikatan dalam molekul, atau dengan menahan molekul berdekatan. Ini meningkatkan kemungkinan reaksi dan menurunkan energi yang dibutuhkan untuk memulainya.
Molekul yang mengikat enzim disebut sebagai substrat. Substrat mengikat bagian kecil dari enzim disebut sebagai situs aktif. Molekul yang dihasilkan pada akhir reaksi disebut 'produk'. Setelah reaksi selesai, enzim melepaskan produk dan siap berikatan dengan substrat lain.
Ada dua teori untuk menjelaskan kerja enzim
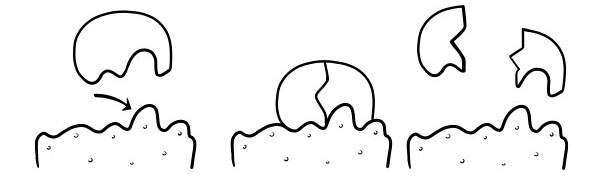
TEORI KUNCI DAN KUNCI
Ini pertama kali didalilkan pada tahun 1894 oleh Emil Fischer. The Lock and Key Hypothesis adalah model bagaimana enzim mengkatalis reaksi substrat. Ini menyatakan bentuk situs aktif enzim persis melengkapi bentuk substrat. Ketika molekul substrat bertabrakan dengan enzim yang bentuk situs aktifnya saling melengkapi, substrat akan masuk ke dalam situs aktif dan kompleks enzim-substrat akan terbentuk. Enzim akan mengkatalisis reaksi, dan produk, bersama dengan enzim akan membentuk kompleks produk-enzim. Menurut model ini, enzim dapat mengkatalisis reaksi balik.
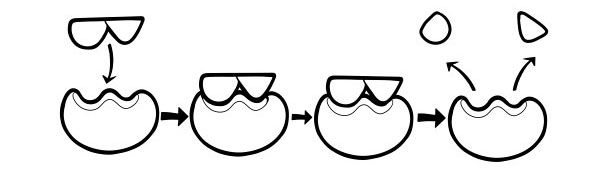
HIPOTESIS INDUCED-FIT
Ini adalah model yang lebih baru dan diterima secara luas untuk menggambarkan cara kerja enzim. Ini menyatakan bahwa bentuk situs aktif tidak persis komplementer tetapi berubah bentuk dengan adanya substrat tertentu menjadi komplementer.
Ketika molekul substrat bertabrakan dengan enzim, jika komposisinya benar, bentuk situs aktif enzim akan berubah sehingga substrat cocok dengannya dan kompleks enzim-substrat dapat terbentuk. Reaksi tersebut kemudian dikatalisis dan bentuk kompleks produk-enzim.
FAKTOR-FAKTOR YANG MEMPENGARUHI AKTIVITAS ENZIM
Lingkungan enzim dan substrat dapat mempengaruhi kecepatan reaksi. Dalam beberapa kasus, lingkungan dapat menyebabkan enzim berhenti bekerja atau bahkan terurai. Ketika enzim berhenti bekerja, kami menyebutnya "didenaturasi".
Berikut adalah beberapa faktor yang dapat mempengaruhi aktivitas enzim:
- Suhu – Suhu dapat mempengaruhi laju reaksi. Semakin tinggi suhu, semakin cepat reaksi akan terjadi. Namun, menaikkan atau menurunkan suhu di luar kisaran yang dapat ditoleransi dapat memengaruhi ikatan kimia di situs aktif, membuatnya kurang cocok untuk mengikat substrat. Suhu yang sangat tinggi dapat menyebabkan enzim mengalami denaturasi, kehilangan bentuk dan aktivitasnya.
- pH – pH juga dapat mempengaruhi fungsi enzim. Residu asam amino situs aktif sering memiliki sifat asam atau basa yang penting untuk katalisis. Perubahan pH dapat mempengaruhi residu ini dan mempersulit substrat untuk berikatan. Enzim bekerja paling baik dalam kisaran pH tertentu, dan seperti suhu, nilai pH ekstrem (asam atau basa) dapat membuat enzim mengalami denaturasi.
- Konsentrasi enzim dan substrat – Laju reaksi meningkat dengan meningkatnya konsentrasi substrat hingga suatu titik, di luar itu peningkatan konsentrasi substrat lebih lanjut tidak menghasilkan perubahan signifikan dalam laju reaksi. Hal ini terjadi karena setelah konsentrasi substrat tertentu, semua sisi aktif enzim sudah penuh dan tidak ada reaksi lebih lanjut yang dapat terjadi.
- Inhibitor - Inhibitor adalah molekul yang dibuat khusus untuk menghentikan aktivitas enzim. Mereka mungkin hanya memperlambat reaksi atau menghentikannya sama sekali. Beberapa inhibitor berikatan dengan enzim yang menyebabkannya berubah bentuk dan tidak bekerja dengan benar. Kebalikan dari inhibitor adalah aktivator yang dapat membantu mempercepat reaksi.
JENIS-JENIS ENZIM
Tubuh manusia terdiri dari enam kelompok besar atau kelas enzim:
- Oksidoreduktase – Enzim ini meningkatkan laju reaksi oksidasi dan reduksi. Dalam reaksi ini, juga disebut reaksi redoks, salah satu reaktan melepaskan sepasang elektron yang diperoleh reaktan lain. Donor pasangan elektron dikatakan teroksidasi dan bertindak sebagai zat pereduksi, sedangkan penerima pasangan elektron yang direduksi disebut zat pengoksidasi. Contohnya termasuk sitokrom oksidase dan laktat dehidrogenase.
- Transferase – Enzim ini mempercepat transfer gugus atom, seperti gugus metil (CH 3 ), asetil (CH 3 CO) atau amino (NH 2 ), dari satu molekul ke molekul lain. Acetate kinase dan alanine deaminase adalah contoh transferase.
- Hidrolase – Enzim ini mempercepat reaksi hidrolisis. Reaksi hidrolisis menggunakan air (H 2 O) untuk memisahkan ikatan dalam molekul untuk membuat dua produk turunan, biasanya dengan membubuhkan -OH (gugus hidroksil) dari air ke salah satu produk dan satu -H (atom hidrogen) ke yang lain. Sementara itu, molekul baru terbentuk dari atom-atom yang digantikan oleh komponen -H dan -OH. Enzim pencernaan lipase dan sukrase adalah hidrolase.
- Lyases – Enzim ini meningkatkan laju penambahan satu gugus molekul ke ikatan rangkap atau penghilangan dua gugus dari atom terdekat untuk membuat ikatan rangkap. Ini bertindak seperti hidrolase, kecuali komponen yang dihilangkan tidak digantikan oleh air atau sebagian air. Kelas enzim ini termasuk oksalat dekarboksilase dan isocitrate lyase.
- Isomerase – Enzim ini mempercepat reaksi isomerisasi. Ini adalah reaksi di mana semua atom asli dalam reaktan dipertahankan, tetapi disusun ulang untuk membentuk isomer reaktan. Isomer adalah molekul dengan rumus kimia yang sama, tetapi susunannya berbeda. Contohnya termasuk isomerase glukosa-fosfat dan alanine racemase.
- Ligases – Juga disebut sintetase, enzim ini meningkatkan laju penggabungan dua molekul. Mereka biasanya melakukannya dengan memanfaatkan energi yang berasal dari pemecahan adenosin trifosfat (ATP). Contoh ligase termasuk asetil-KoA sintetase dan DNA ligase.

