obiettivi formativi
In questa lezione impareremo
- Cosa sono gli enzimi?
- Principali caratteristiche degli enzimi
- Come funzionano gli enzimi?
- Ipotesi della serratura e della chiave
- Ipotesi di adattamento indotto
- Fattori chiave che influenzano l'attività enzimatica
- Sei diversi tipi di enzimi
COSA SONO GLI ENZIMI?
Gli enzimi sono catalizzatori biologici che accelerano le reazioni chimiche senza essere essi stessi alterati nel processo. Un sistema vivente controlla la sua attività attraverso gli enzimi.
Alcuni esempi di enzimi sono
- Lattasi: scompone il lattosio in glucosio e galattosio
- Catalasi: scompone il perossido di idrogeno in acqua e ossigeno
- Glicogeno sintasi – Catalizza la formazione di legami glicosidici tra le molecole di glucosio
- ATPasi – Scompone l'ATP in ADP, producendo energia
QUALI SONO LE PRINCIPALI CARATTERISTICHE DEGLI ENZIMI?
- La funzione di base di un enzima è aumentare la velocità di una reazione.
- Gli enzimi sono specifici, cioè hanno una forma specifica, quindi solo un certo substrato si adatterà al suo sito attivo
- Gli enzimi sono regolati da uno stato di bassa attività ad alta attività e viceversa
COME FUNZIONANO GLI ENZIMI?
La maggior parte delle reazioni in una cellula richiedono temperature molto elevate per andare avanti, il che distruggerebbe la cellula. Gli enzimi agiscono abbassando l'energia di attivazione di una reazione. L'energia di attivazione di una reazione viene abbassata sollecitando i legami all'interno di una molecola o tenendo le molecole vicine tra loro. Ciò aumenta la probabilità di una reazione e quindi riduce l'energia richiesta per avviarla.
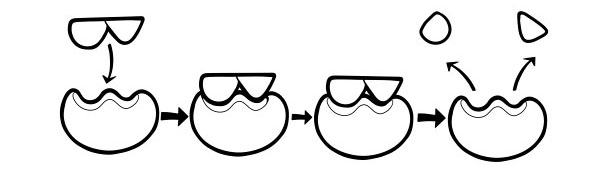
La molecola con cui l'enzima si lega è chiamata substrato. Il substrato si lega a una piccola sezione dell'enzima denominato sito attivo. La molecola prodotta alla fine della reazione è chiamata 'prodotto'. Una volta che la reazione è completa, l'enzima rilascia il prodotto ed è pronto per legarsi con un altro substrato.
Ci sono due teorie per spiegare l'azione dell'enzima
SERRATURA E TEORIA DELLA CHIAVE
Fu postulato per la prima volta nel 1894 da Emil Fischer. L'ipotesi Lock and Key è un modello di come gli enzimi catalizzano le reazioni del substrato. Afferma che la forma dei siti attivi degli enzimi è esattamente complementare alla forma del substrato. Quando una molecola di substrato collide con un enzima la cui forma del sito attivo è complementare, il substrato si adatterà al sito attivo e si formerà un complesso enzima-substrato. L'enzima catalizzerà la reazione ei prodotti, insieme all'enzima, formeranno un complesso enzima-prodotto. Secondo questo modello, è possibile per un enzima catalizzare una reazione inversa.
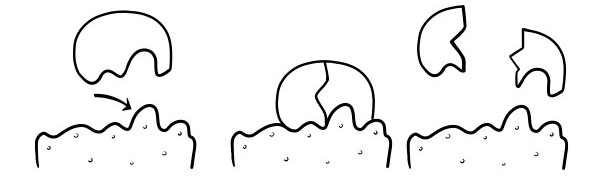
IPOTESI DI ADATTAMENTO INDOTTO
Questo è un modello più recente e ampiamente accettato per descrivere il modo in cui funzionano gli enzimi. Afferma che la forma dei siti attivi non è esattamente complementare ma cambia forma in presenza di un substrato specifico per diventare complementare.
Quando una molecola di substrato collide con un enzima, se la sua composizione è specificamente corretta, la forma del sito attivo dell'enzima cambierà in modo che il substrato si adatti al suo e si possa formare un complesso enzima-substrato. La reazione viene quindi catalizzata e si forma un complesso enzima-prodotto.
FATTORI CHE INFLUENZANO L'ATTIVITÀ ENZIMATICA
L'ambiente dell'enzima e il substrato possono influenzare la velocità della reazione. In alcuni casi, l'ambiente può far sì che l'enzima smetta di funzionare o addirittura si sveli. Quando un enzima smette di funzionare, lo chiamiamo "denaturato".
Ecco alcuni fattori che possono influenzare l'attività enzimatica:
- Temperatura – La temperatura può influenzare la velocità di reazione. Maggiore è la temperatura, più rapida sarà la reazione. Tuttavia, l'aumento o la diminuzione della temperatura al di fuori di un intervallo tollerabile può influenzare i legami chimici nel sito attivo, rendendoli meno adatti a legare i substrati. Temperature molto elevate possono causare la denaturazione di un enzima, perdendo forma e attività.
- pH – Il pH può anche influenzare la funzione enzimatica. I residui amminoacidici del sito attivo hanno spesso proprietà acide o basiche che sono importanti per la catalisi. Le variazioni di pH possono influenzare questi residui e rendere difficile il legame dei substrati. Gli enzimi funzionano meglio entro un certo intervallo di pH e, come per la temperatura, valori di pH estremi (acidi o basici) possono far denaturare gli enzimi.
- La concentrazione di enzimi e substrato - La velocità di reazione aumenta con l'aumentare della concentrazione del substrato fino a un punto, oltre il quale qualsiasi ulteriore aumento della concentrazione del substrato non produce cambiamenti significativi nella velocità di reazione. Ciò si verifica perché dopo una certa concentrazione del substrato, tutti i siti attivi sull'enzima sono pieni e non possono verificarsi ulteriori reazioni.
- Inibitori - Gli inibitori sono molecole create appositamente per arrestare l'attività degli enzimi. Potrebbero semplicemente rallentare la reazione o fermarla del tutto. Alcuni inibitori si legano all'enzima facendolo cambiare forma e non funzionare correttamente. L'opposto di un inibitore è un attivatore che può aiutare ad accelerare la reazione.
TIPI DI ENZIMI
Il corpo umano è costituito da sei principali gruppi o classi di enzimi:
- Ossidoreduttasi - Questi enzimi aumentano la velocità delle reazioni di ossidazione e riduzione. In queste reazioni, chiamate anche reazioni redox, uno dei reagenti cede una coppia di elettroni che un altro reagente guadagna. Si dice che il donatore di coppie di elettroni sia ossidato e agisca come agente riducente, mentre il destinatario di coppie di elettroni è ridotto è chiamato agente ossidante. Gli esempi includono citocromo ossidasi e lattato deidrogenasi.
- Transferasi – Questi enzimi accelerano insieme al trasferimento di gruppi di atomi, come i gruppi metile (CH 3 ), acetile (CH 3 CO) o amminico (NH 2 ), da una molecola a un'altra molecola. Acetato chinasi e alanina deaminasi sono esempi di transferasi.
- Idrolasi – Questi enzimi accelerano le reazioni di idrolisi. Le reazioni di idrolisi usano l'acqua (H 2 O) per scindere un legame in una molecola per creare due prodotti figli, di solito apponendo l'-OH (gruppo ossidrile) dall'acqua a uno dei prodotti e un singolo -H (atomo di idrogeno) a l'altro. Nel frattempo, una nuova molecola si forma dagli atomi spostati dai componenti -H e -OH. Gli enzimi digestivi lipasi e sucrasi sono idrolasi.
- Liasi - Questi enzimi aumentano la velocità di aggiunta di un gruppo molecolare a un doppio legame o la rimozione di due gruppi da atomi vicini per creare un doppio legame. Questi agiscono come idrolasi, tranne per il fatto che il componente rimosso non viene spostato dall'acqua o da porzioni di acqua. Questa classe di enzimi include l'ossalato decarbossilasi e l'isocitrato liasi.
- Isomerasi : questi enzimi accelerano le reazioni di isomerizzazione. Queste sono reazioni in cui tutti gli atomi originali nel reagente vengono trattenuti, ma vengono riorganizzati per formare un isomero del reagente. Gli isomeri sono molecole con la stessa formula chimica, ma disposizioni diverse. Gli esempi includono glucosio-fosfato isomerasi e alanina racemasi.
- Ligasi - Chiamate anche sintetasi, questi enzimi aumentano la velocità di unione di due molecole. Di solito ottengono questo risultato utilizzando l'energia derivata dalla scomposizione dell'adenosina trifosfato (ATP). Esempi di ligasi includono acetil-CoA sintetasi e DNA ligasi.

