学習目標
このレッスンでは、
- 酵素とは?
- 酵素の主な特徴
- 酵素はどのように働くのですか?
- ロックとキーの仮説
- 誘導適合仮説
- 酵素活性に影響を与える主な要因
- 6種類の酵素
酵素とは?
酵素は、プロセス中に変化することなく化学反応を加速する生物学的触媒です。生物系は、酵素を通じてその活動を制御します。
酵素の例としては、
- ラクターゼ - ラクトースをグルコースとガラクトースに分解します
- カタラーゼ – 過酸化水素を水と酸素に分解します
- グリコーゲン合成酵素 - グルコース分子間のグリコシド結合の形成を触媒します
- ATPase – ATP を ADP に分解し、エネルギーを生成します
酵素の主な特徴は何ですか?
- 酵素の基本的な機能は、反応速度を上げることです。
- 酵素は特異的です。つまり、特定の形状を持っているため、特定の基質のみがその活性部位に適合します。
- 酵素は活性の低い状態から活性の高い状態へ、またその逆に調節されています。
酵素はどのように機能しますか?
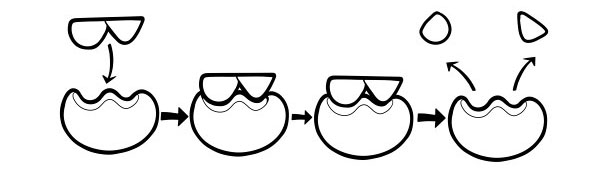
細胞内のほとんどの反応は、細胞を破壊する非常に高い温度を必要とします。酵素は、反応の活性化エネルギーを下げることによって機能します。反応の活性化エネルギーは、分子内の結合にストレスをかけるか、分子を近づけることによって低下します。これにより、反応の可能性が高まり、反応を開始するために必要なエネルギーが低下します。
酵素が結合する分子は基質と呼ばれます。基質は、活性部位と呼ばれる酵素の小さな部分に結合します。反応の最後に生成される分子は「生成物」と呼ばれます。反応が完了すると、酵素は生成物を放出し、別の基質と結合する準備が整います。
酵素の作用を説明するには2つの理論があります
ロックと鍵理論
1894年にエミール・フィッシャーによって最初に仮定されました。ロック アンド キー仮説は、酵素が基質反応を触媒する方法のモデルです。それは、酵素の活性部位の形状が基質の形状に正確に相補的であると述べています.活性部位の形状が相補的な酵素に基質分子が衝突すると、基質が活性部位に収まり、酵素-基質複合体が形成されます。酵素は反応を触媒し、生成物は酵素と一緒に酵素-生成物複合体を形成します。このモデルによれば、酵素が逆反応を触媒することが可能です。
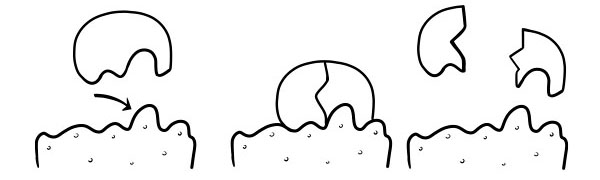
誘導適合仮説
これは、酵素の働きを説明するための最近の広く受け入れられているモデルです。活性部位の形状は完全に相補的ではなく、特定の基質の存在下で形状が変化して相補的になると述べています。
基質分子が酵素と衝突すると、その組成が正確であれば、酵素の活性部位の形状が変化し、基質がその中に収まり、酵素-基質複合体が形成されます。その後、反応が触媒され、酵素-生成物複合体が形成されます。
酵素活性に影響を与える要因
酵素と基質の環境は、反応速度に影響を与える可能性があります。場合によっては、環境によって酵素が機能しなくなったり、分解されたりすることさえあります.酵素が働かなくなった状態を「変性」と呼びます。
酵素活性に影響を与える可能性のあるいくつかの要因を次に示します。
- 温度– 温度は反応速度に影響を与える可能性があります。温度が高いほど、反応は速くなります。ただし、許容範囲外の温度の上昇または低下は、活性部位の化学結合に影響を与え、基質との結合にあまり適していない可能性があります。非常に高い温度は酵素を変性させ、その形状と活性を失う可能性があります.
- pH – pH も酵素機能に影響を与える可能性があります。活性部位のアミノ酸残基は、多くの場合、触媒作用にとって重要な酸性または塩基性特性を持っています。 pH の変化はこれらの残基に影響を与え、基質が結合しにくくなる可能性があります。酵素は特定の pH 範囲内で最もよく機能し、温度と同様に極端な pH 値 (酸性または塩基性) では酵素が変性する可能性があります。
- 酵素と基質の濃度– 反応速度は、基質濃度の増加に伴って増加し、それを超えると基質濃度が増加しても反応速度に大きな変化は生じません。これは、基質が特定の濃度になると、酵素のすべての活性部位がいっぱいになり、それ以上の反応が起こらなくなるために起こります。
- 阻害剤- 阻害剤は、酵素の活性を止めるために特別に作られた分子です。彼らは反応を遅くするか、完全に止めるかもしれません.一部の阻害剤は酵素と結合し、酵素の形状を変化させ、正しく機能しません。阻害剤の反対は、反応を加速するのに役立つ活性剤です。
酵素の種類
人体は、酵素の 6 つの主要なグループまたはクラスで構成されています。
- オキシドレダクターゼ– これらの酵素は、酸化および還元反応の速度を高めます。酸化還元反応とも呼ばれるこれらの反応では、反応物の 1 つが別の反応物が得る電子対を放棄します。電子対供与体は酸化されて還元剤として作用すると言われ、電子対受容体が還元されることは酸化剤と呼ばれます。例としては、シトクロムオキシダーゼおよび乳酸脱水素酵素が挙げられます。
- トランスフェラーゼ– これらの酵素は、メチル (CH 3 )、アセチル (CH 3 CO) またはアミノ (NH 2 ) 基などの原子のグループを、ある分子から別の分子に移動する速度を速めます。酢酸キナーゼおよびアラニンデアミナーゼはトランスフェラーゼの例です。
- 加水分解酵素– これらの酵素は加水分解反応を加速します。加水分解反応では、水 (H 2 O) を使用して分子内の結合を分割し、通常は水からの -OH (ヒドロキシル基) を生成物の 1 つに結合させ、単一の -H (水素原子) を結合させて 2 つの娘生成物を生成します。もう一方。その間に、新しい分子は、-H および -OH 成分によって置換された原子から形成されます。消化酵素のリパーゼとスクラーゼは加水分解酵素です。
- リアーゼ– これらの酵素は、1 つの分子グループを二重結合に付加する速度、または近くの原子から 2 つのグループを除去して二重結合を作成する速度を高めます。これらは、除去された成分が水または水の一部によって置換されないことを除いて、加水分解酵素のように機能します。このクラスの酵素には、シュウ酸デカルボキシラーゼおよびイソクエン酸リアーゼが含まれます。
- イソメラーゼ– これらの酵素は、異性化反応を加速します。これらは、反応物中の元の原子のすべてが保持される反応ですが、反応物の異性体を形成するために再配置されます。異性体は、化学式は同じですが、配置が異なる分子です。例としては、グルコースリン酸イソメラーゼおよびアラニンラセマーゼが挙げられる。
- リガーゼ– シンテターゼとも呼ばれるこれらの酵素は、2 つの分子の結合速度を高めます。彼らは通常、アデノシン三リン酸(ATP)の分解に由来するエネルギーを利用してこれを達成します.リガーゼの例には、アセチル-CoAシンセターゼおよびDNAリガーゼが含まれる。

