Цели на учење
Во оваа лекција, ќе научиме
- Што се ензими?
- Главни карактеристики на ензимите
- Како функционираат ензимите?
- Заклучување и клучна хипотеза
- Хипотеза за вклопување
- Клучни фактори кои влијаат на активноста на ензимите
- Шест различни видови на ензими
ШТО Е ЕНЗИМИ?
Ензимите се биолошки катализатори кои ги забрзуваат хемиските реакции без самите да се променат во процесот. Livingивиот систем ја контролира својата активност преку ензими.
Некои примери на ензими се
- Лактаза - ја разложува лактозата во гликоза и галактоза
- Каталаза - го разложува водородниот пероксид во вода и кислород
- Гликоген синтаза - го катализира формирањето на гликозидните врски помеѓу молекулите на гликоза
- АТПаза - Го распаѓа АТП во АДП, произведува енергија
КОИ СЕ ГЛАВНИ КАРАКТЕРИСТИКИ НА ЕНЗИМИ?
- Основната функција на ензимот е да се зголеми стапката на реакција.
- Ензимите се специфични, односно имаат специфична форма, затоа само одредена подлога ќе одговара на неговата активна локација
- Ензимите се регулираат од состојба на мала активност до висока активност и обратно
КАКО РАБОТНИТЕ ЕНЗИМИ?
Повеќето реакции во ќелијата бараат многу високи температури за да се одвиваат, што би ја уништило ќелијата. Ензимите работат со намалување на активирањето на енергијата на реакција. Енергијата на активирање на реакција се намалува со ставање стрес на врските во рамките на молекулата или со држење на молекулите близу до себе. Ова ја зголемува веројатноста за појава на реакција и така ја намалува потребната енергија за нејзино започнување.
Молекулата со која се врзува ензимот се нарекува подлога. Подлогата се врзува за мал дел од ензимот наведен како активна локација. Молекулот произведен на крајот на реакцијата се нарекува „производ“. Откако реакцијата е завршена, ензимот го ослободува производот и е подготвен да се врзува со друг супстрат.
Постојат две теории за да се објасни дејството на ензимот
Локална и клучна теорија
Прв пат беше објавено во 1894 година од Емил Фишер. Хипотезата за заклучување и клуч е модел за тоа како ензимите реагираат на реакциите на катализаторот на подлогата. Во него се наведува формата на активните места на ензимите е точно комплементарна со формата на подлогата. Кога молекулата на подлогата се судира со ензим чија активна форма на страницата е комплементарна, подлогата ќе се вклопи во активното место и ќе се формира комплекс на ензим-подлога. Ензимот ќе ја катализира реакцијата, а производите, заедно со ензимот ќе формираат комплекс на ензимски производи. Според овој модел, можно е ензим да ја катализира реакцијата.
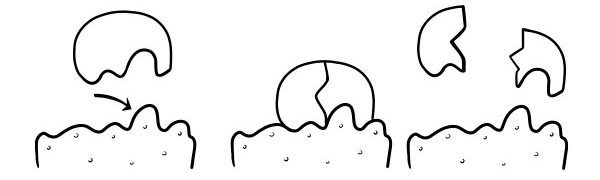
ИНДУКИТИВНА ХИПОТЕЗА
Ова е неодамнешен и широко прифатен модел за да се опише начинот на кој функционираат ензимите. Во него се наведува дека формата на активните места не е точно комплементарна, но промена на формата во присуство на специфична подлога за да стане комплементарна.
Кога молекулата на подлогата се судира со ензим, ако неговиот состав е специфично точен, формата на активното место на ензимот ќе се промени така што подлогата се вклопува во неговата и може да се формира комплексни ензими-подлоги. Реакцијата потоа се катализира и комплексно форма на ензим-производ.
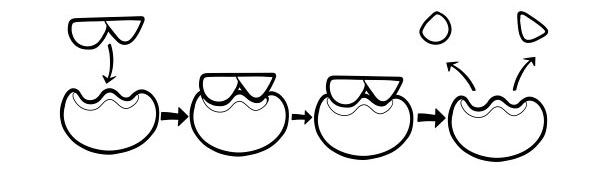
ФАКТОРИ кои влијаат врз активирањето на ензимот
Опкружувањето на ензимот и подлогата може да влијае на брзината на реакцијата. Во некои случаи, околината може да предизвика ензимот да престане да работи, па дури и да се расплетува. Кога ензимот престанува да работи, ние го нарекуваме „денатуриран“.
Еве неколку фактори кои можат да влијаат на ензимската активност:
- Температура - Температурата може да влијае на стапката на реакција. Колку е поголема температурата, толку побрзо ќе се појави реакцијата. Сепак, или зголемувањето или намалувањето на температурата надвор од толерантниот опсег може да влијае на хемиските врски на активното место, што ги прави помалку прилагодени за врзување на подлоги. Многу високи температури може да предизвикаат денатурирање на ензимот, губејќи ја својата форма и активност.
- pH - pH може исто така да влијае на функцијата на ензимот. Остатоците од аминокиселините на активна локација често имаат кисели или основни својства што се важни за катализата. Промените во рН може да влијаат на овие остатоци и ќе го отежнат врзувањето на подлогата. Ензимите работат најдобро во одреден опсег на pH, и како и со температурата, екстремните вредности на рН (кисела или основна) можат да направат ензими да бидат денатурирани.
- Концентрација на ензими и подлоги - Стапката на реакција се зголемува со зголемување на концентрацијата на подлогата до точка, над која понатамошното зголемување на концентрацијата на подлогата не дава значителна промена во стапката на реакција. Ова се случува затоа што по одредена концентрација на подлогата, сите активни места на ензимот се полни и не може да се појави понатамошна реакција.
- Инхибитори - инхибитори се молекули кои се специјално направени за да се запре активноста на ензимите. Тие може само да ја забават реакцијата или да ја запрат заедно. Некои инхибитори се врзуваат со ензимот предизвикувајќи таа да се промени формата и да не работи правилно. Спротивно на инхибиторот е активатор што може да помогне да се забрза реакцијата.
ВИДОВИ НА ЕНYИМИ
Човечкото тело се состои од шест главни групи или класи на ензими:
- Оксидордуктази - овие ензими ја зголемуваат брзината на реакциите на оксидација и намалување. Во овие реакции, исто така наречени редокси реакции, еден од реактантите се откажува од пар електрони кои друг реактант ги стекнува. Донаторот на електронски пар се вели дека се оксидира и делува како средство за намалување, додека примачот на електро-пар е намален се нарекува оксидирачки агенс. Примерите вклучуваат цитохром оксидаза и лактат дехидрогеназа.
- Трансверазите - Овие ензими брзина заедно со трансфер на групи на атоми, како што се метил (CH3), ацетил (CH3 CO) или амино (NH2) групи, од една молекула кон друга молекула. Ацетат киназа и аланин деаминиза се примери на трансферази.
- Хидролази - овие ензими ги забрзуваат реакциите на хидролиза. Реакциите на хидролиза користат вода (H 2 O) за да се подели врска во молекула за да се создадат две производи ќерки, обично со ставање на -OH (хидроксилна група) од водата на еден од производите и единечен-H (водороден атом) до другиот. Во меѓувреме, се формира нова молекула од атомите раселени од компонентите -H и -OH. Дигестивните ензими липаза и сахараза се хидролази.
- Лијази - Овие ензими ја зголемуваат стапката на додавање на една молекуларна група во двојна врска или отстранување на две групи од околните атоми за создавање на двојна врска. Овие дејствуваат како хидролази, освен тоа што отстранетата компонента не е поместена од вода или порции вода. Во оваа класа на ензими спаѓаат оксалат декарбоксилаза и изоциратната лиаза.
- Изомерази - овие ензими ги забрзуваат реакциите на изомеризација. Ова се реакции во кои се задржуваат сите оригинални атоми во реактантот, но се преуредуваат за да формираат изомер на реактантот. Изомери се молекули со иста хемиска формула, но различни аранжмани. Примерите вклучуваат изомераза на гликоза-фосфат и аланин ракемаза.
- Лигази - исто така наречени синтетази, овие ензими ја зголемуваат стапката на спојување на две молекули. Тие обично го постигнуваат ова со употреба на енергија добиена од расипување на аденозин трифосфат (АТП). Примери на лигази вклучуваат ацетил-CoA синтетаза и ДНК лигаза.

