leerdoelen
In deze les leren we
- Wat zijn enzymen?
- Belangrijkste kenmerken van enzymen
- Hoe werken enzymen?
- Slot- en sleutelhypothese
- Induced-Fit-hypothese
- Belangrijkste factoren die de enzymactiviteit beïnvloeden
- Zes verschillende soorten enzymen
WAT ZIJN ENZYMEN?
Enzymen zijn biologische katalysatoren die de chemische reacties versnellen zonder dat ze zelf veranderen. Een levend systeem regelt zijn activiteit door middel van enzymen.
Enkele voorbeelden van enzymen zijn:
- Lactase - Het breekt lactose af in glucose en galactose
- Catalase - Het breekt waterstofperoxide af in water en zuurstof
- Glycogeensynthase - Het katalyseert de vorming van glycosidische bindingen tussen glucosemoleculen
- ATPase - Het breekt ATP af in ADP en produceert energie
WAT ZIJN DE BELANGRIJKSTE KENMERKEN VAN ENZYMEN?
- De basisfunctie van een enzym is om de reactiesnelheid te verhogen.
- Enzymen zijn specifiek, dat wil zeggen dat ze een specifieke vorm hebben, daarom past alleen een bepaald substraat op zijn actieve plaats
- Enzymen worden gereguleerd van een toestand van lage activiteit naar hoge activiteit en vice versa
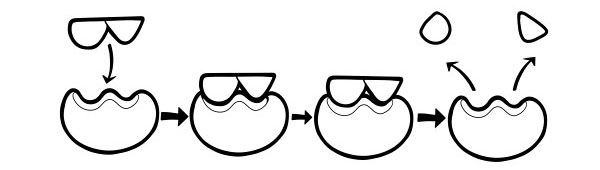
HOE WERKEN ENZYMEN?
De meeste reacties in een cel vereisen zeer hoge temperaturen om op gang te komen, wat de cel zou vernietigen. Enzymen werken door de activeringsenergie van een reactie te verlagen. De activeringsenergie van een reactie wordt verlaagd door de bindingen in een molecuul te belasten of door moleculen dicht bij elkaar te houden. Dit vergroot de kans op een reactie en verlaagt zo de energie die nodig is om deze te starten.
Het molecuul waarmee het enzym bindt wordt het substraat genoemd. Het substraat bindt aan een klein deel van het enzym dat de actieve plaats wordt genoemd. Het molecuul dat aan het einde van de reactie wordt geproduceerd, wordt 'product' genoemd. Zodra de reactie is voltooid, geeft het enzym het product vrij en is het klaar om te binden met een ander substraat.
Er zijn twee theorieën om de enzymwerking te verklaren:
SLOT EN SLEUTEL THEORIE
Het werd voor het eerst gepostuleerd in 1894 door Emil Fischer. De Lock and Key-hypothese is een model van hoe enzymen katalysatorsubstraatreacties veroorzaken. Het stelt dat de vorm van de actieve plaatsen van enzymen precies complementair is aan de vorm van het substraat. Wanneer een substraatmolecuul botst met een enzym waarvan de vorm van de actieve plaats complementair is, zal het substraat in de actieve plaats passen en zal zich een enzym-substraatcomplex vormen. Het enzym zal de reactie katalyseren en de producten zullen samen met het enzym een enzym-productcomplex vormen. Volgens dit model is het mogelijk dat een enzym een omgekeerde reactie katalyseert.
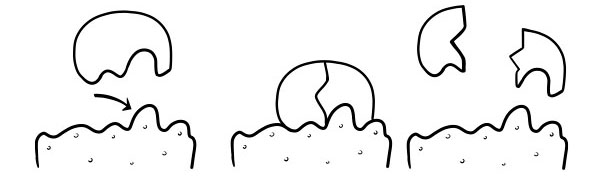
INDUCED-FIT HYPOTHESE
Dit is een recenter en algemeen aanvaard model om de werking van enzymen te beschrijven. Het stelt dat de vorm van actieve plaatsen niet precies complementair is, maar van vorm verandert in de aanwezigheid van een specifiek substraat om complementair te worden.
Wanneer een substraatmolecuul in botsing komt met een enzym, als de samenstelling specifiek correct is, zal de vorm van de actieve plaats van het enzym veranderen, zodat het substraat in het enzym past en zich een enzym-substraatcomplex kan vormen. De reactie wordt vervolgens gekatalyseerd en er ontstaat een enzym-productcomplex.
FACTOREN DIE DE ENZYMACTIVITEIT BENVLOEDEN
De omgeving van het enzym en het substraat kan de reactiesnelheid beïnvloeden. In sommige gevallen kan de omgeving ervoor zorgen dat het enzym stopt met werken of zelfs ontrafelt. Wanneer een enzym niet meer werkt, noemen we het "gedenatureerd".
Hier zijn enkele factoren die de enzymactiviteit kunnen beïnvloeden:
- Temperatuur – De temperatuur kan de reactiesnelheid beïnvloeden. Hoe hoger de temperatuur, hoe sneller de reactie zal plaatsvinden. Het verhogen of verlagen van de temperatuur buiten een aanvaardbaar bereik kan echter de chemische bindingen in de actieve plaats beïnvloeden, waardoor ze minder geschikt zijn om substraten te binden. Zeer hoge temperaturen kunnen ertoe leiden dat een enzym denatureert, waardoor het zijn vorm en activiteit verliest.
- pH – pH kan ook de enzymfunctie beïnvloeden. Aminozuurresiduen op de actieve plaats hebben vaak zure of basische eigenschappen die belangrijk zijn voor katalyse. Veranderingen in pH kunnen deze residuen beïnvloeden en het moeilijk maken voor substraten om te binden. Enzymen werken het beste binnen een bepaald pH-bereik, en net als bij temperatuur kunnen extreme pH-waarden (zuur of basisch) enzymen denatureren.
- De concentratie van enzymen en substraat - De reactiesnelheid neemt toe met toenemende substraatconcentratie tot een punt, waarboven een verdere toename van de substraatconcentratie geen significante verandering in reactiesnelheid veroorzaakt. Dit gebeurt omdat na een bepaalde concentratie van het substraat alle actieve plaatsen op het enzym vol zijn en er geen verdere reactie kan plaatsvinden.
- Remmers - Remmers zijn moleculen die speciaal zijn gemaakt om de activiteit van enzymen te stoppen. Ze kunnen de reactie gewoon vertragen of helemaal stoppen. Sommige remmers binden zich aan het enzym waardoor het van vorm verandert en niet correct werkt. Het tegenovergestelde van een remmer is een activator die kan helpen om de reactie te versnellen.
SOORTEN ENZYMEN
Het menselijk lichaam bestaat uit zes hoofdgroepen of klassen van enzymen:
- Oxidoreductasen - Deze enzymen verhogen de snelheid van oxidatie- en reductiereacties. Bij deze reacties, ook wel redoxreacties genoemd, geeft een van de reactanten een elektronenpaar af dat een andere reactant krijgt. De donor van het elektronenpaar wordt geoxideerd en werkt als een reductiemiddel, terwijl de ontvanger van het elektronenpaar het oxidatiemiddel wordt genoemd. Voorbeelden zijn cytochroomoxidase en lactaatdehydrogenase.
- Transferasen – Deze enzymen versnellen samen met de overdracht van groepen atomen, zoals methyl (CH 3 ), acetyl (CH 3 CO ) of amino (NH 2 ) groepen, van het ene molecuul naar het andere molecuul. Acetaatkinase en alaninedeaminase zijn voorbeelden van transferasen.
- Hydrolasen - Deze enzymen versnellen hydrolysereacties. Hydrolysereacties gebruiken water (H 2 O) om een binding in een molecuul te splitsen om twee dochterproducten te creëren, meestal door de -OH (hydroxylgroep) van het water aan een van de producten en een enkele -H (waterstofatoom) aan te brengen de andere. Ondertussen wordt een nieuw molecuul gevormd uit de atomen die verdrongen zijn door de -H- en -OH-componenten. De spijsverteringsenzymen lipase en sucrase zijn hydrolasen.
- Lyasen - Deze enzymen verhogen de snelheid van de toevoeging van één moleculaire groep aan een dubbele binding of de verwijdering van twee groepen van nabijgelegen atomen om een dubbele binding te creëren. Deze werken als hydrolasen, behalve dat de verwijderde component niet wordt verdrongen door water of delen van water. Deze klasse van enzymen omvat oxalaatdecarboxylase en isocitraatlyase.
- Isomerasen - Deze enzymen versnellen isomerisatiereacties. Dit zijn reacties waarbij alle oorspronkelijke atomen in de reactant behouden blijven, maar worden herschikt om een isomeer van de reactant te vormen. Isomeren zijn moleculen met dezelfde chemische formule, maar verschillende rangschikkingen. Voorbeelden zijn glucosefosfaatisomerase en alanineracemase.
- Ligasen - Ook wel synthetasen genoemd, deze enzymen verbeteren de snelheid van het samenvoegen van twee moleculen. Ze bereiken dit meestal door gebruik te maken van energie die wordt verkregen uit de afbraak van adenosinetrifosfaat (ATP). Voorbeelden van ligasen omvatten acetyl-CoA-synthetase en DNA-ligase.

