Cele kształcenia
W tej lekcji nauczymy się
- Co to są enzymy?
- Główne cechy enzymów
- Jak działają enzymy?
- Hipoteza zamka i klucza
- Hipoteza dopasowania indukowanego
- Kluczowe czynniki wpływające na aktywność enzymów
- Sześć różnych rodzajów enzymów
CZYM SĄ ENZYMY?
Enzymy to biologiczne katalizatory, które przyspieszają reakcje chemiczne, nie ulegając zmianie w procesie. Żywy system kontroluje swoją aktywność poprzez enzymy.
Oto kilka przykładów enzymów
- Laktaza – rozkłada laktozę na glukozę i galaktozę
- Katalaza – Rozkłada nadtlenek wodoru na wodę i tlen
- Syntaza glikogenu – Katalizuje tworzenie wiązań glikozydowych między cząsteczkami glukozy
- ATPaza – Rozkłada ATP na ADP, wytwarzając energię
JAKIE SĄ GŁÓWNE WŁAŚCIWOŚCI ENZYMÓW?
- Podstawową funkcją enzymu jest zwiększenie szybkości reakcji.
- Enzymy są specyficzne, tzn. mają określony kształt, dlatego tylko określony substrat będzie pasował do swojego miejsca aktywnego
- Enzymy są regulowane ze stanu niskiej aktywności do wysokiej aktywności i odwrotnie
JAK DZIAŁAJĄ ENZYMY?
Większość reakcji w komórce wymaga do zajścia bardzo wysokich temperatur, które zniszczyłyby komórkę. Enzymy działają poprzez obniżenie energii aktywacji reakcji. Energia aktywacji reakcji jest obniżana poprzez wywieranie nacisku na wiązania w cząsteczce lub utrzymywanie cząsteczek blisko siebie. Zwiększa to prawdopodobieństwo wystąpienia reakcji, a tym samym obniża energię potrzebną do jej rozpoczęcia.
Cząsteczka, z którą wiąże się enzym, nazywana jest substratem. Substrat wiąże się z niewielką częścią enzymu, zwaną miejscem aktywnym. Cząsteczka powstająca pod koniec reakcji nazywana jest „produktem”. Po zakończeniu reakcji enzym uwalnia produkt i jest gotowy do wiązania się z innym substratem.
Istnieją dwie teorie wyjaśniające działanie enzymu
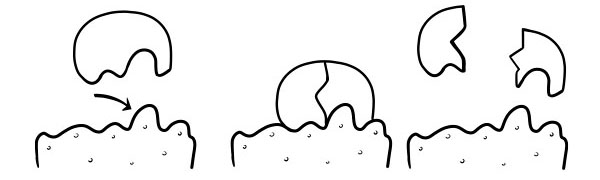
TEORIA ZAMKA I KLUCZA
Po raz pierwszy postulował to w 1894 roku Emil Fischer. Hipoteza zamka i klucza jest modelem tego, jak enzymy katalizują reakcje substratów. Stwierdza, że kształt miejsc aktywnych enzymów jest dokładnie komplementarny do kształtu substratu. Kiedy cząsteczka substratu zderza się z enzymem, którego kształt miejsca aktywnego jest komplementarny, substrat dopasuje się do miejsca aktywnego i powstanie kompleks enzym-substrat. Enzym będzie katalizował reakcję, a produkty wraz z enzymem utworzą kompleks enzym-produkt. Zgodnie z tym modelem enzym może katalizować reakcję odwrotną.
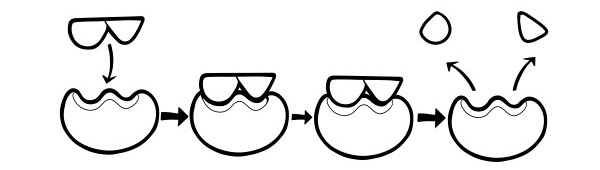
HIPOTEZA DOPASOWANIA INDUKCYJNEGO
Jest to nowszy i powszechnie akceptowany model opisujący sposób działania enzymów. Stwierdza, że kształt miejsc aktywnych nie jest dokładnie komplementarny, ale zmienia kształt w obecności określonego substratu, aby stać się komplementarnym.
Kiedy cząsteczka substratu zderza się z enzymem, jeśli jego skład jest szczególnie prawidłowy, kształt miejsca aktywnego enzymu zmieni się tak, że substrat pasuje do niego i może powstać kompleks enzym-substrat. Reakcja jest następnie katalizowana i tworzy się kompleks enzym-produkt.
CZYNNIKI WPŁYWAJĄCE NA AKTYWNOŚĆ ENZYMU
Środowisko enzymu i substratu może wpływać na szybkość reakcji. W niektórych przypadkach środowisko może spowodować, że enzym przestanie działać lub nawet się rozpadnie. Kiedy enzym przestaje działać, nazywamy go „denaturowanym”.
Oto kilka czynników, które mogą wpływać na aktywność enzymów:
- Temperatura – Temperatura może wpływać na szybkość reakcji. Im wyższa temperatura, tym szybciej zajdzie reakcja. Jednak zwiększanie lub obniżanie temperatury poza dopuszczalny zakres może wpływać na wiązania chemiczne w miejscu aktywnym, czyniąc je mniej odpowiednimi do wiązania substratów. Bardzo wysokie temperatury mogą spowodować denaturację enzymu, utratę jego kształtu i aktywności.
- pH – pH może również wpływać na działanie enzymów. Reszty aminokwasowe miejsca aktywnego często mają właściwości kwasowe lub zasadowe, które są ważne dla katalizy. Zmiany pH mogą wpływać na te pozostałości i utrudniać wiązanie substratów. Enzymy działają najlepiej w określonym zakresie pH i podobnie jak w przypadku temperatury, skrajne wartości pH (kwaśne lub zasadowe) mogą powodować denaturację enzymów.
- Stężenie enzymów i substratu - Szybkość reakcji wzrasta wraz ze wzrostem stężenia substratu do punktu, powyżej którego dalszy wzrost stężenia substratu nie powoduje znaczącej zmiany w szybkości reakcji. Dzieje się tak, ponieważ po pewnym stężeniu substratu wszystkie miejsca aktywne enzymu są pełne i dalsza reakcja nie może zajść.
- Inhibitory - Inhibitory to molekuły stworzone specjalnie w celu zatrzymania aktywności enzymów. Mogą po prostu spowolnić reakcję lub całkowicie ją zatrzymać. Niektóre inhibitory wiążą się z enzymem, powodując jego zmianę kształtu i nieprawidłowe działanie. Przeciwieństwem inhibitora jest aktywator, który może przyspieszyć reakcję.
RODZAJE ENZYMÓW
Ciało ludzkie składa się z sześciu głównych grup lub klas enzymów:
- Oksydoreduktazy – Enzymy te zwiększają szybkość reakcji utleniania i redukcji. W tych reakcjach, zwanych także reakcjami redoks, jeden z reagentów oddaje parę elektronów, którą zyskuje inny reagent. Mówi się, że donor pary elektronów jest utleniony i działa jako środek redukujący, podczas gdy odbiorca pary elektronów jest redukowany, nazywany jest środkiem utleniającym. Przykłady obejmują oksydazę cytochromową i dehydrogenazę mleczanową.
- Transferazy – Enzymy te przyspieszają wraz z przenoszeniem grup atomów, takich jak grupa metylowa (CH 3 ), acetylowa (CH 3 CO) lub aminowa (NH 2 ), z jednej cząsteczki do drugiej. Przykładami transferaz są kinaza octanowa i deaminaza alaninowa.
- Hydrolazy – Enzymy te przyspieszają reakcje hydrolizy. Reakcje hydrolizy wykorzystują wodę (H 2 O) do rozbicia wiązania w cząsteczce w celu utworzenia dwóch produktów potomnych, zwykle poprzez przyłączenie -OH (grupy hydroksylowej) z wody do jednego z produktów i pojedynczego -H (atomu wodoru) do inny. W międzyczasie z atomów zastąpionych składnikami -H i -OH powstaje nowa cząsteczka. Enzymy trawienne lipaza i sacharaza są hydrolazami.
- Liazy – Enzymy te zwiększają szybkość dodawania jednej grupy cząsteczkowej do wiązania podwójnego lub usuwania dwóch grup z pobliskich atomów w celu utworzenia wiązania podwójnego. Działają one jak hydrolazy, z tą różnicą, że usunięty składnik nie jest wypierany przez wodę lub części wody. Ta klasa enzymów obejmuje dekarboksylazę szczawianową i liazę izocytrynianową.
- Izomerazy – Enzymy te przyspieszają reakcje izomeryzacji. Są to reakcje, w których wszystkie pierwotne atomy reagenta są zachowane, ale są przegrupowane, tworząc izomer reagenta. Izomery to cząsteczki o tym samym wzorze chemicznym, ale różnych układach. Przykłady obejmują izomerazę glukozo-fosforanową i racemazę alaninową.
- Ligazy – zwane także syntetazami, enzymy te zwiększają szybkość łączenia dwóch cząsteczek. Zwykle osiągają to, wykorzystując energię pochodzącą z rozkładu trójfosforanu adenozyny (ATP). Przykłady ligaz obejmują syntetazę acetylo-CoA i ligazę DNA.

