objetivos de aprendizado
Nesta lição, vamos aprender
- O que são enzimas?
- Principais características das enzimas
- Como funcionam as enzimas?
- Hipótese de fechadura e chave
- Hipótese de Ajuste Induzido
- Principais fatores que afetam a atividade enzimática
- Seis tipos diferentes de enzimas
O QUE SÃO ENZIMAS?
As enzimas são catalisadores biológicos que aceleram as reações químicas sem serem alteradas no processo. Um sistema vivo controla sua atividade por meio de enzimas.
Alguns exemplos de enzimas são
- Lactase - Decompõe a lactose em glicose e galactose
- Catalase – Quebra o peróxido de hidrogênio em água e oxigênio
- Glicogênio sintase – Catalisa a formação de ligações glicosídicas entre as moléculas de glicose
- ATPase – Quebra o ATP em ADP, produzindo energia
QUAIS SÃO AS PRINCIPAIS CARACTERÍSTICAS DAS ENZIMAS?
- A função básica de uma enzima é aumentar a velocidade de uma reação.
- As enzimas são específicas, ou seja, têm uma forma específica, portanto, apenas um determinado substrato se encaixará em seu sítio ativo
- As enzimas são reguladas de um estado de baixa atividade para alta atividade e vice-versa
COMO FUNCIONAM AS ENZIMAS?
A maioria das reações em uma célula requer temperaturas muito altas para funcionar, o que destruiria a célula. As enzimas funcionam diminuindo a energia de ativação de uma reação. A energia de ativação de uma reação é diminuída colocando pressão sobre as ligações dentro de uma molécula, ou mantendo as moléculas próximas umas das outras. Isso aumenta a probabilidade de uma reação e, portanto, diminui a energia necessária para iniciá-la.
A molécula com a qual a enzima se liga é chamada de substrato. O substrato liga-se a uma pequena parte da enzima referida como o sítio ativo. A molécula produzida no final da reação é chamada de 'produto'. Uma vez que a reação está completa, a enzima libera o produto e está pronta para se ligar a outro substrato.
Existem duas teorias para explicar a ação da enzima
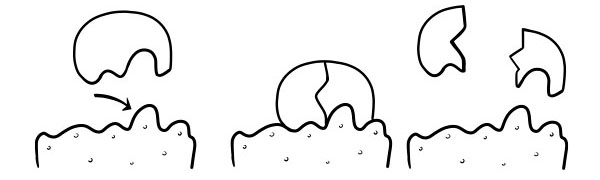
TEORIA DE FECHAMENTO E CHAVE
Foi postulado pela primeira vez em 1894 por Emil Fischer. A hipótese da fechadura e chave é um modelo de como as enzimas catalisam as reações do substrato. Ele afirma que a forma dos sítios ativos das enzimas é exatamente complementar à forma do substrato. Quando uma molécula de substrato colide com uma enzima cujo formato do sítio ativo é complementar, o substrato se encaixa no sítio ativo e forma-se um complexo enzima-substrato. A enzima catalisará a reação e os produtos, juntamente com a enzima, formarão um complexo enzima-produto. De acordo com este modelo, é possível que uma enzima catalise uma reação inversa.
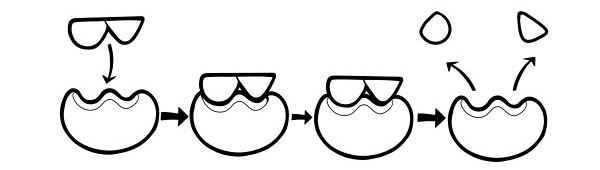
HIPÓTESE DE AJUSTE INDUZIDO
Este é um modelo mais recente e amplamente aceito para descrever a forma como as enzimas funcionam. Ela afirma que a forma dos sítios ativos não é exatamente complementar, mas muda de forma na presença de um substrato específico para se tornar complementar.
Quando uma molécula de substrato colide com uma enzima, se sua composição estiver especificamente correta, a forma do sítio ativo da enzima mudará para que o substrato se encaixe nele e um complexo enzima-substrato possa se formar. A reação é então catalisada e um complexo enzima-produto se forma.
FATORES QUE AFETAM A ATIVIDADE ENZIMÁTICA
O ambiente da enzima e o substrato podem afetar a velocidade da reação. Em alguns casos, o ambiente pode fazer com que a enzima pare de funcionar ou até mesmo se desfaça. Quando uma enzima para de funcionar, nós a chamamos de “desnaturada”.
Aqui estão alguns fatores que podem afetar a atividade enzimática:
- Temperatura – A temperatura pode afetar a taxa de reação. Quanto maior a temperatura, mais rápida será a reação. No entanto, aumentar ou diminuir a temperatura fora de uma faixa tolerável pode afetar as ligações químicas no sítio ativo, tornando-as menos adequadas para ligar substratos. Temperaturas muito altas podem causar a desnaturação de uma enzima, perdendo sua forma e atividade.
- pH – o pH também pode afetar a função enzimática. Os resíduos de aminoácidos do sítio ativo geralmente têm propriedades ácidas ou básicas que são importantes para a catálise. Mudanças no pH podem afetar esses resíduos e dificultar a ligação dos substratos. As enzimas funcionam melhor dentro de uma determinada faixa de pH e, assim como a temperatura, valores extremos de pH (ácidos ou básicos) podem desnaturar as enzimas.
- A concentração de enzimas e substrato – A taxa de reação aumenta com o aumento da concentração de substrato até um ponto, além do qual qualquer aumento adicional na concentração de substrato não produz nenhuma mudança significativa na taxa de reação. Isso ocorre porque após uma certa concentração do substrato, todos os sítios ativos da enzima estão cheios e nenhuma outra reação pode ocorrer.
- Inibidores - Inibidores são moléculas que são feitas especialmente para interromper a atividade das enzimas. Eles podem apenas retardar a reação ou pará-la completamente. Alguns inibidores se ligam à enzima fazendo com que ela mude de forma e não funcione corretamente. O oposto de um inibidor é um ativador que pode ajudar a acelerar a reação.
TIPOS DE ENZIMAS
O corpo humano consiste em seis grandes grupos ou classes de enzimas:
- Oxidorredutases – Essas enzimas aumentam a taxa de reações de oxidação e redução. Nessas reações, também chamadas de reações redox, um dos reagentes cede um par de elétrons que outro reagente ganha. Diz-se que o doador do par de elétrons é oxidado e age como um agente redutor, enquanto o receptor do par de elétrons é reduzido é chamado de agente oxidante. Exemplos incluem citocromo oxidase e lactato desidrogenase.
- Transferases – Essas enzimas aceleram a transferência de grupos de átomos, como grupos metil (CH 3 ), acetil (CH 3 CO) ou amino (NH 2 ), de uma molécula para outra. Acetato quinase e alanina desaminase são exemplos de transferases.
- Hidrolases – Estas enzimas aceleram as reações de hidrólise. As reações de hidrólise usam água (H 2 O) para dividir uma ligação em uma molécula para criar dois produtos-filhos, geralmente fixando o -OH (grupo hidroxila) da água a um dos produtos e um único -H (átomo de hidrogênio) ao o outro. Enquanto isso, uma nova molécula é formada a partir dos átomos deslocados pelos componentes -H e -OH. As enzimas digestivas lipase e sacarase são hidrolases.
- Liases – Essas enzimas aumentam a taxa de adição de um grupo molecular a uma ligação dupla ou a remoção de dois grupos de átomos próximos para criar uma ligação dupla. Estes agem como hidrolases, exceto que o componente removido não é deslocado por água ou porções de água. Esta classe de enzimas inclui oxalato descarboxilase e isocitrato liase.
- Isomerases – Estas enzimas aceleram as reações de isomerização. Estas são reações nas quais todos os átomos originais do reagente são retidos, mas são rearranjados para formar um isômero do reagente. Isômeros são moléculas com a mesma fórmula química, mas com arranjos diferentes. Exemplos incluem glicose-fosfato isomerase e alanina racemase.
- Ligases – Também chamadas de sintetases, essas enzimas aumentam a taxa de união de duas moléculas. Eles geralmente fazem isso usando a energia derivada da quebra do trifosfato de adenosina (ATP). Exemplos de ligases incluem acetil-CoA sintetase e DNA ligase.

