Цели обучения
На этом уроке мы узнаем
- Что такое ферменты?
- Основные характеристики ферментов
- Как работают ферменты?
- Гипотеза замка и ключа
- Гипотеза индуцированной подгонки
- Ключевые факторы, влияющие на активность ферментов
- Шесть различных типов ферментов
ЧТО ТАКОЕ ФЕРМЕНТЫ?
Ферменты - это биологические катализаторы, которые ускоряют химические реакции, не изменяясь при этом сами. Живая система контролирует свою деятельность с помощью ферментов.
Некоторые примеры ферментов:
- Лактаза - расщепляет лактозу на глюкозу и галактозу.
- Каталаза - расщепляет перекись водорода на воду и кислород.
- Гликогенсинтаза - катализирует образование гликозидных связей между молекулами глюкозы.
- АТФаза - расщепляет АТФ на АДФ, производя энергию.
КАКОВЫ ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ФЕРМЕНТОВ?
- Основная функция фермента - увеличить скорость реакции.
- Ферменты специфичны, т. Е. Имеют определенную форму, поэтому только определенный субстрат подходит для их активного сайта.
- Ферменты регулируются от состояния низкой активности до состояния высокой активности и наоборот.
КАК РАБОТАЮТ ФЕРМЕНТЫ?
Большинство реакций в клетке требует очень высоких температур, что может разрушить клетку. Ферменты работают за счет снижения энергии активации реакции. Энергия активации реакции снижается за счет нагрузки на связи внутри молекулы или за счет удерживания молекул близко друг к другу. Это увеличивает вероятность реакции и снижает энергию, необходимую для ее начала.
Молекула, с которой связывается фермент, называется субстратом. Субстрат связывается с небольшим участком фермента, называемым активным центром. Молекула, образующаяся в конце реакции, называется «продуктом». После завершения реакции фермент высвобождает продукт и готов к связыванию с другим субстратом.
Есть две теории, объясняющие действие фермента.
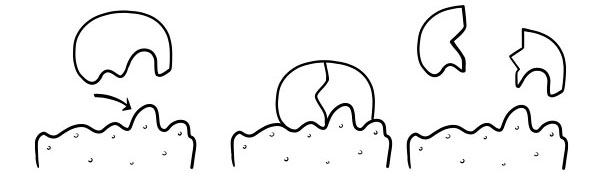
ТЕОРИЯ ЗАМКА И КЛЮЧА
Впервые это было высказано в 1894 году Эмилем Фишером. Гипотеза замка и ключа представляет собой модель того, как ферменты катализируют реакции субстрата. Он утверждает, что форма активных центров ферментов точно дополняет форму субстрата. Когда молекула субстрата сталкивается с ферментом, форма активного сайта которого комплементарна, субстрат входит в активный центр и образуется комплекс фермент-субстрат. Фермент будет катализировать реакцию, и продукты вместе с ферментом образуют комплекс фермент-продукт. Согласно этой модели, фермент может катализировать обратную реакцию.
ИНДУЦИРОВАННАЯ ГИПОТЕЗА
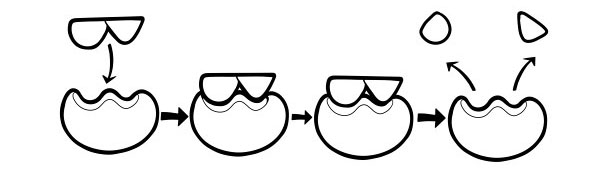
Это более новая и широко принятая модель для описания работы ферментов. Он утверждает, что форма активных центров не совсем комплементарна, но меняют форму в присутствии определенного субстрата, чтобы стать комплементарными.
Когда молекула субстрата сталкивается с ферментом, если ее состав определенно правильный, форма активного центра фермента изменится, так что субстрат впишется в него, и может образоваться комплекс фермент-субстрат. Затем реакция катализируется и образуется комплекс фермент-продукт.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
Окружение фермента и субстрата может влиять на скорость реакции. В некоторых случаях окружающая среда может привести к тому, что фермент перестанет работать или даже распадется. Когда фермент перестает работать, мы называем его «денатурированным».
Вот некоторые факторы, которые могут повлиять на активность ферментов:
- Температура - Температура может влиять на скорость реакции. Чем выше температура, тем быстрее будет протекать реакция. Однако повышение или понижение температуры за пределами допустимого диапазона может повлиять на химические связи в активном центре, делая их менее подходящими для связывания субстратов. Очень высокие температуры могут привести к денатурированию фермента, потере его формы и активности.
- pH - pH также может влиять на функцию ферментов. Аминокислотные остатки активного центра часто обладают кислотными или основными свойствами, которые важны для катализа. Изменения pH могут повлиять на эти остатки и затруднить связывание субстратов. Ферменты лучше всего работают в определенном диапазоне pH, и, как и в случае с температурой, экстремальные значения pH (кислотные или щелочные) могут вызвать денатурацию ферментов.
- Концентрация ферментов и субстрата . Скорость реакции увеличивается с увеличением концентрации субстрата до точки, за которой любое дальнейшее увеличение концентрации субстрата не приводит к значительному изменению скорости реакции. Это происходит потому, что после определенной концентрации субстрата все активные центры фермента заполняются и дальнейшая реакция невозможна.
- Ингибиторы. Ингибиторы - это молекулы, специально созданные для остановки активности ферментов. Они могут просто замедлить реакцию или вовсе прекратить ее. Некоторые ингибиторы связываются с ферментом, заставляя его менять форму и работать некорректно. Противоположность ингибитору - активатор, который может помочь ускорить реакцию.
ВИДЫ ФЕРМЕНТОВ
Человеческий организм состоит из шести основных групп или классов ферментов:
- Оксидоредуктазы - эти ферменты увеличивают скорость окислительных и восстановительных реакций. В этих реакциях, также называемых окислительно-восстановительными реакциями, один из реагентов отдает пару электронов, которую получает другой реагент. Сообщается, что донор электронной пары окисляется и действует как восстанавливающий агент, в то время как реципиент электронной пары восстанавливается, что называется окислителем. Примеры включают цитохромоксидазу и лактатдегидрогеназу.
- Трансферазы - эти ферменты ускоряют перенос групп атомов, таких как метильная (CH 3 ), ацетильная (CH 3 CO) или амино (NH 2 ) группы, от одной молекулы к другой молекуле. Ацетаткиназа и аланиндезаминаза являются примерами трансфераз.
- Гидролазы - эти ферменты ускоряют реакции гидролиза. В реакциях гидролиза используется вода (H 2 O) для расщепления связи в молекуле с образованием двух дочерних продуктов, обычно путем присоединения -OH (гидроксильная группа) из воды к одному из продуктов и одного -H (атом водорода) к одному из продуктов. другой. Тем временем новая молекула образуется из атомов, замещенных компонентами -H и -OH. Пищеварительные ферменты липаза и сахароза представляют собой гидролазы.
- Лиазы - эти ферменты увеличивают скорость присоединения одной молекулярной группы к двойной связи или удаления двух групп из соседних атомов для создания двойной связи. Они действуют как гидролазы, за исключением того, что удаленный компонент не замещается водой или порциями воды. Этот класс ферментов включает оксалатдекарбоксилазу и изоцитратлиазу.
- Изомеразы - эти ферменты ускоряют реакции изомеризации. Это реакции, в которых все исходные атомы в реагенте сохраняются, но перегруппировываются с образованием изомера реагента. Изомеры - это молекулы с одинаковой химической формулой, но разным расположением. Примеры включают глюкозофосфатизомеразу и аланинрацемазу.
- Лигазы - также называемые синтетазами, эти ферменты увеличивают скорость соединения двух молекул. Обычно они достигают этого, используя энергию, полученную при расщеплении аденозинтрифосфата (АТФ). Примеры лигаз включают ацетил-КоА-синтетазу и ДНК-лигазу.

