Objektivat e mësimit
Në këtë mësim do të mësojmë
- Çfarë janë enzimat?
- Karakteristikat kryesore të enzimave
- Si funksionojnë enzimat?
- Hipoteza e bllokimit dhe çelësit
- Hipoteza e përshtatur e induktuar
- Faktorët kryesorë që ndikojnë në aktivitetin e enzimës
- Gjashtë lloje të ndryshme enzimash
ÇFARË JANË ENZIMET?
Enzimat janë katalizatorë biologjikë që përshpejtojnë reaksionet kimike pa u ndryshuar vetë gjatë procesit. Një sistem i gjallë kontrollon aktivitetin e tij nëpërmjet enzimave.
Disa shembuj të enzimave janë
- Laktaza – zbërthen laktozën në glukozë dhe galaktozë
- Katalaza – Ai zbërthen peroksidin e hidrogjenit në ujë dhe oksigjen
- Glikogjen sintaza - Katalizon formimin e lidhjeve glikozidike midis molekulave të glukozës
- ATPase – zbërthen ATP në ADP, duke prodhuar energji
CILAT JANË KARAKTERISTIKAT KRYESORE TË ENZIMËVE?
- Funksioni themelor i një enzime është të rrisë shpejtësinë e një reaksioni.
- Enzimat janë specifike dmth kanë një formë specifike, prandaj vetëm një substrat i caktuar do të përshtatet me vendin e tij aktiv
- Enzimat rregullohen nga një gjendje me aktivitet të ulët në aktivitet të lartë dhe anasjelltas
SI FUNKSIONON ENZIMET?
Shumica e reaksioneve në një qelizë kërkojnë temperatura shumë të larta për të filluar, gjë që do ta shkatërronte qelizën. Enzimat punojnë duke ulur energjinë e aktivizimit të një reaksioni. Energjia e aktivizimit të një reaksioni zvogëlohet duke ushtruar stres në lidhjet brenda një molekule, ose duke mbajtur molekulat afër njëra-tjetrës. Kjo rrit gjasat e një reaksioni dhe kështu ul energjinë e nevojshme për fillimin e tij.
Molekula me të cilën lidhet enzima quhet substrat. Substrati lidhet me një seksion të vogël të enzimës që quhet zona aktive. Molekula e prodhuar në fund të reaksionit quhet 'produkt'. Pasi të përfundojë reaksioni, enzima lëshon produktin dhe është gati për t'u lidhur me një substrat tjetër.
Ekzistojnë dy teori për të shpjeguar veprimin e enzimës
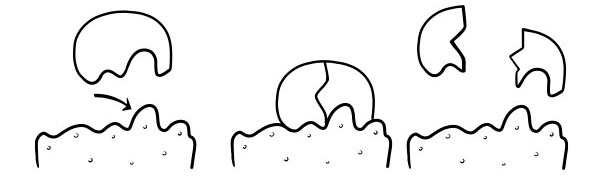
TEORIA E BLLOKIMIT DHE CELESIT
Për herë të parë u postulua në 1894 nga Emil Fischer. Hipoteza Lock and Key është një model se si enzimat katalizojnë reaksionet e substratit. Ai thotë se forma e vendeve aktive të enzimave është saktësisht plotësuese me formën e substratit. Kur një molekulë e substratit përplaset me një enzimë, forma e zonës aktive të së cilës është plotësuese, substrati do të përshtatet në zonën aktive dhe do të formohet një kompleks enzimë-substrat. Enzima do të katalizojë reaksionin, dhe produktet, së bashku me enzimën do të formojnë një kompleks enzimë-produkt. Sipas këtij modeli, është e mundur që një enzimë të katalizojë një reaksion të kundërt.
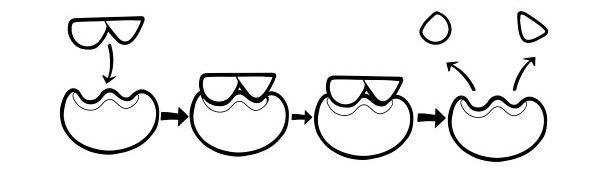
HIPOTEZA E INDUCED-FIT
Ky është një model më i fundit dhe i pranuar gjerësisht për të përshkruar mënyrën se si funksionojnë enzimat. Ai thotë se forma e vendeve aktive nuk është saktësisht plotësuese, por ndryshon formën në prani të një substrati specifik për t'u bërë plotësuese.
Kur një molekulë e substratit përplaset me një enzimë, nëse përbërja e saj është saktësisht e saktë, forma e vendit aktiv të enzimës do të ndryshojë në mënyrë që substrati të përshtatet në të dhe të mund të formohet një kompleks enzimë-substrat. Reaksioni më pas katalizohet dhe formohet një kompleks enzimë-produkt.
FAKTORËT QË NDIKOJNË NË AKTIVITETIN E ENZIMËS
Mjedisi i enzimës dhe i substratit mund të ndikojnë në shpejtësinë e reaksionit. Në disa raste, mjedisi mund të bëjë që enzima të ndalojë së punuari apo edhe të zbërthehet. Kur një enzimë ndalon së punuari, ne e quajmë atë "të denatyruar".
Këtu janë disa faktorë që mund të ndikojnë në aktivitetin e enzimës:
- Temperatura - Temperatura mund të ndikojë në shpejtësinë e reagimit. Sa më e lartë të jetë temperatura, aq më shpejt do të ndodhë reagimi. Sidoqoftë, rritja ose ulja e temperaturës jashtë një diapazoni të tolerueshëm mund të ndikojë në lidhjet kimike në zonën aktive, duke i bërë ato më pak të përshtatshme për të lidhur substrate. Temperaturat shumë të larta mund të bëjnë që një enzimë të denatyrohet, duke humbur formën dhe aktivitetin e saj.
- pH – pH gjithashtu mund të ndikojë në funksionin e enzimës. Mbetjet e aminoacideve të zonës aktive shpesh kanë veti acidike ose bazike që janë të rëndësishme për katalizën. Ndryshimet në pH mund të ndikojnë në këto mbetje dhe ta bëjnë të vështirë lidhjen e substrateve. Enzimat funksionojnë më mirë brenda një intervali të caktuar pH, dhe si me temperaturën, vlerat ekstreme të pH (acid ose bazë) mund t'i bëjnë enzimat të denatyrohen.
- Përqendrimi i enzimave dhe substratit - Shpejtësia e reaksionit rritet me rritjen e përqendrimit të substratit deri në një pikë, përtej së cilës çdo rritje e mëtejshme e përqendrimit të substratit nuk prodhon ndryshim të rëndësishëm në shpejtësinë e reagimit. Kjo ndodh sepse pas një përqendrimi të caktuar të substratit, të gjitha vendet aktive në enzimë janë plot dhe nuk mund të ndodhë asnjë reagim i mëtejshëm.
- Frenuesit - Inhibitorët janë molekula që janë krijuar posaçërisht për të ndaluar aktivitetin e enzimave. Ata thjesht mund të ngadalësojnë reagimin ose ta ndalojnë atë krejtësisht. Disa frenues lidhen me enzimën duke bërë që ajo të ndryshojë formën dhe të mos funksionojë siç duhet. E kundërta e një frenuesi është një aktivizues që mund të ndihmojë në përshpejtimin e reagimit.
LLOJET E ENZIMËVE
Trupi i njeriut përbëhet nga gjashtë grupe ose klasa të mëdha enzimash:
- Oksidoreduktazat – Këto enzima rrisin shkallën e reaksioneve të oksidimit dhe reduktimit. Në këto reaksione, të quajtura gjithashtu reaksione redoks, një nga reaktantët heq dorë nga një palë elektrone që fiton një reaktant tjetër. Dhuruesi i çiftit elektronik thuhet se është i oksiduar dhe vepron si agjent reduktues, ndërsa marrësi i çiftit elektronik është reduktuar quhet agjent oksidues. Shembujt përfshijnë citokrom oksidazën dhe laktat dehidrogjenazën.
- Transferazat - Këto enzima shpejtojnë së bashku me transferimin e grupeve të atomeve, të tilla si grupet metil (CH 3 ), acetil (CH 3 CO) ose amino (NH 2 ), nga një molekulë në një molekulë tjetër. Acetate kinaza dhe alanine deaminaza janë shembuj të transferazave.
- Hidrolaza – Këto enzima përshpejtojnë reaksionet e hidrolizës. Reaksionet e hidrolizës përdorin ujin (H 2 O) për të ndarë një lidhje në një molekulë për të krijuar dy produkte të bija, zakonisht duke ngjitur -OH (grupin hidroksil) nga uji në një nga produktet dhe një -H të vetëm (atom hidrogjeni) në tjetri. Ndërkohë, një molekulë e re formohet nga atomet e zhvendosur nga përbërësit -H dhe -OH. Enzimat tretëse lipaza dhe saharaza janë hidrolaza.
- Liazat - Këto enzima rrisin shkallën e shtimit të një grupi molekular në një lidhje të dyfishtë ose heqjen e dy grupeve nga atomet e afërta për të krijuar një lidhje të dyfishtë. Këto veprojnë si hidrolaza, me përjashtim të faktit që përbërësi i hequr nuk zhvendoset nga uji ose nga pjesët e ujit. Kjo klasë e enzimave përfshin oksalate dekarboksilazën dhe izocitrat liazën.
- Izomerazat – Këto enzima përshpejtojnë reaksionet e izomerizimit. Këto janë reaksione në të cilat të gjithë atomet origjinale në reaktant mbahen, por riorganizohen për të formuar një izomer të reaktantit. Izomerët janë molekula me të njëjtën formulë kimike, por rregullime të ndryshme. Shembujt përfshijnë izomerazën e glukozës-fosfatit dhe alaninës racemazën.
- Ligazat - Të quajtura gjithashtu sintetaza, këto enzima rrisin shpejtësinë e bashkimit të dy molekulave. Ata zakonisht e arrijnë këtë duke përdorur energjinë që rrjedh nga shpërbërja e adenozinës trifosfatit (ATP). Shembuj të ligazave përfshijnë acetil-CoA sintetazën dhe ADN ligazën.

