วัตถุประสงค์การเรียนรู้
ในบทเรียนนี้ เราจะได้เรียนรู้
- เอนไซม์คืออะไร?
- ลักษณะสำคัญของเอนไซม์
- เอนไซม์ทำงานอย่างไร?
- สมมติฐานล็อคและคีย์
- สมมติฐานที่เหนี่ยวนำให้เกิดพอดี
- ปัจจัยสำคัญที่ส่งผลต่อการทำงานของเอนไซม์
- เอ็นไซม์ 6 ชนิด
เอนไซม์คืออะไร?
เอ็นไซม์เป็นตัวเร่งปฏิกิริยาทางชีวภาพที่เร่งปฏิกิริยาเคมีโดยไม่เปลี่ยนแปลงในกระบวนการ ระบบที่มีชีวิตควบคุมกิจกรรมของมันผ่านเอนไซม์
ตัวอย่างของเอนไซม์ได้แก่
- แลคเตส - แบ่งแลคโตสเป็นกลูโคสและกาแลคโตส
- Catalase – ย่อยสลายไฮโดรเจนเปอร์ออกไซด์ลงในน้ำและออกซิเจน
- Glycogen synthase – กระตุ้นการสร้างพันธะไกลโคซิดิกระหว่างโมเลกุลกลูโคส
- ATPase – แบ่ง ATP เป็น ADP เพื่อสร้างพลังงาน
ลักษณะสำคัญของเอนไซม์คืออะไร?
- หน้าที่พื้นฐานของเอนไซม์คือการเพิ่มอัตราการเกิดปฏิกิริยา
- เอ็นไซม์มีความเฉพาะเจาะจง กล่าวคือ มีรูปร่างจำเพาะ ดังนั้น ซับสเตรตบางตัวเท่านั้นที่จะพอดีกับไซต์ที่ทำงานของมัน
- เอ็นไซม์ถูกควบคุมจากสถานะของกิจกรรมต่ำไปจนถึงกิจกรรมสูงและในทางกลับกัน
เอนไซม์ทำงานอย่างไร?
ปฏิกิริยาส่วนใหญ่ในเซลล์ต้องการอุณหภูมิที่สูงมากจึงจะไปได้ ซึ่งจะทำลายเซลล์ เอนไซม์ทำงานโดยลดพลังงานกระตุ้นของปฏิกิริยา พลังงานกระตุ้นของปฏิกิริยาจะลดลงโดยสร้างความเครียดบนพันธะภายในโมเลกุล หรือโดยการจับโมเลกุลไว้ใกล้กัน สิ่งนี้จะเพิ่มโอกาสในการเกิดปฏิกิริยาและลดพลังงานที่จำเป็นในการเริ่มต้น
โมเลกุลที่เอนไซม์จับเรียกว่าสารตั้งต้น ซับสเตรตจับกับส่วนเล็กๆ ของเอนไซม์ที่เรียกว่าแอคทีฟไซต์ โมเลกุลที่ผลิตขึ้นเมื่อสิ้นสุดปฏิกิริยาเรียกว่า 'ผลิตภัณฑ์' เมื่อปฏิกิริยาเสร็จสิ้น เอนไซม์จะปล่อยผลิตภัณฑ์และพร้อมที่จะจับกับสารตั้งต้นอื่น
มีสองทฤษฎีที่อธิบายการทำงานของเอนไซม์
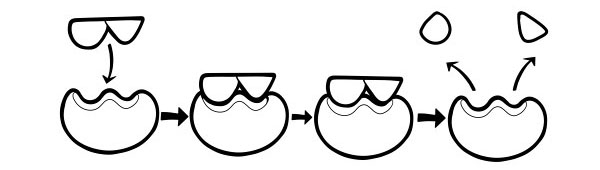
ทฤษฎีการล็อคและกุญแจ
มันถูกตั้งสมมติฐานครั้งแรกในปี 1894 โดย Emil Fischer Lock and Key Hypothesis เป็นแบบจำลองว่าเอนไซม์เร่งปฏิกิริยาของสารตั้งต้นอย่างไร มันระบุรูปร่างของไซต์แอคทีฟไซต์ของเอนไซม์ที่ประกอบกับรูปร่างของซับสเตรตอย่างแน่นอน เมื่อโมเลกุลของซับสเตรตชนกับเอ็นไซม์ที่รูปร่างของแอคทีฟไซต์เป็นส่วนเติมเต็ม ซับสเตรตจะพอดีกับไซต์แอคทีฟและคอมเพล็กซ์ของสารตั้งต้นของเอ็นไซม์จะก่อตัวขึ้น เอ็นไซม์จะเร่งปฏิกิริยา และผลิตภัณฑ์ ร่วมกับเอ็นไซม์จะสร้างคอมเพล็กซ์ผลิตภัณฑ์เอนไซม์ ตามแบบจำลองนี้ เอนไซม์สามารถกระตุ้นปฏิกิริยาย้อนกลับได้
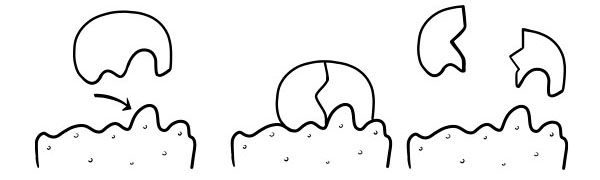
สมมติฐานที่จูงใจให้พอดี
นี่เป็นแบบจำลองล่าสุดและเป็นที่ยอมรับกันอย่างกว้างขวางในการอธิบายวิธีการทำงานของเอนไซม์ มันระบุว่ารูปร่างของไซต์ที่ทำงานอยู่ไม่ได้เสริมกันอย่างแน่นอน แต่เปลี่ยนรูปร่างเมื่อมีสารตั้งต้นเฉพาะเพื่อให้กลายเป็นส่วนเสริม
เมื่อโมเลกุลของสารตั้งต้นชนกับเอ็นไซม์ ถ้าองค์ประกอบของมันถูกต้องโดยเฉพาะ รูปร่างของไซต์แอคทีฟของเอนไซม์จะเปลี่ยนไปเพื่อให้ซับสเตรตเข้ากับตัวของมันเอง และคอมเพล็กซ์ของสารตั้งต้นของเอนไซม์สามารถก่อตัวได้ ปฏิกิริยาจะถูกเร่งปฏิกิริยาและเกิดรูปแบบที่ซับซ้อนของผลิตภัณฑ์เอนไซม์
ปัจจัยที่มีผลต่อการทำงานของเอนไซม์
สภาพแวดล้อมของเอนไซม์และสารตั้งต้นอาจส่งผลต่อความเร็วของปฏิกิริยา ในบางกรณี สิ่งแวดล้อมอาจทำให้เอ็นไซม์หยุดทำงานหรือคลี่คลายได้ เมื่อเอ็นไซม์หยุดทำงาน เราเรียกว่า “denatured”
นี่คือปัจจัยบางอย่างที่อาจส่งผลต่อการทำงานของเอนไซม์:
- อุณหภูมิ – อุณหภูมิสามารถส่งผลต่ออัตราการเกิดปฏิกิริยา อุณหภูมิยิ่งสูง ปฏิกิริยาก็จะยิ่งเร็วขึ้น อย่างไรก็ตาม การเพิ่มหรือลดอุณหภูมิที่อยู่นอกช่วงที่ยอมรับได้อาจส่งผลต่อพันธะเคมีในบริเวณที่ทำงาน ซึ่งทำให้ไม่เหมาะที่จะจับซับสเตรต อุณหภูมิที่สูงมากอาจทำให้เอนไซม์เสื่อมสภาพ ทำให้สูญเสียรูปร่างและกิจกรรม
- pH – pH ยังส่งผลต่อการทำงานของเอนไซม์ สารตกค้างของกรดอะมิโนที่ทำงานอยู่มักจะมีคุณสมบัติที่เป็นกรดหรือเป็นเบสที่มีความสำคัญต่อการเร่งปฏิกิริยา การเปลี่ยนแปลงของค่า pH อาจส่งผลต่อสารตกค้างเหล่านี้และทำให้ซับสเตรตจับยาก เอนไซม์ทำงานได้ดีที่สุดในช่วง pH ที่แน่นอน และเช่นเดียวกับอุณหภูมิ ค่า pH ที่สูงเกินไป (ที่เป็นกรดหรือด่าง) สามารถทำให้เอนไซม์เสียสภาพได้
- ความเข้มข้นของเอ็นไซม์และซับสเตรต – อัตราการเกิดปฏิกิริยาเพิ่มขึ้นเมื่อความเข้มข้นของซับสเตรตเพิ่มขึ้นจนถึงจุดหนึ่ง ซึ่งเกินกว่าที่ความเข้มข้นของซับสเตรตเพิ่มขึ้นอีกจะไม่ก่อให้เกิดการเปลี่ยนแปลงที่มีนัยสำคัญในอัตราการเกิดปฏิกิริยา สิ่งนี้เกิดขึ้นเนื่องจากหลังจากความเข้มข้นของซับสเตรตบางตำแหน่ง แอคทีฟไซต์ทั้งหมดบนเอ็นไซม์จะเต็มและไม่มีปฏิกิริยาเกิดขึ้นอีก
- สารยับยั้ง - สารยับยั้งคือโมเลกุลที่ทำขึ้นเป็นพิเศษเพื่อหยุดการทำงานของเอนไซม์ พวกเขาอาจชะลอปฏิกิริยาหรือหยุดโดยสิ้นเชิง สารยับยั้งบางชนิดเกาะกับเอ็นไซม์ทำให้เปลี่ยนแปลงรูปร่างและทำงานไม่ถูกต้อง ตรงกันข้ามกับตัวยับยั้งคือตัวกระตุ้นที่สามารถช่วยเร่งปฏิกิริยาได้
ประเภทของเอนไซม์
ร่างกายมนุษย์ประกอบด้วยกลุ่มหรือกลุ่มหลักของเอนไซม์หกกลุ่ม:
- Oxidoreductases – เอนไซม์เหล่านี้ช่วยเพิ่มอัตราการเกิดปฏิกิริยาออกซิเดชันและปฏิกิริยารีดักชัน ในปฏิกิริยาเหล่านี้ เรียกอีกอย่างว่าปฏิกิริยารีดอกซ์ สารตั้งต้นตัวใดตัวหนึ่งจะปล่อยอิเล็กตรอนคู่หนึ่งไปซึ่งสารตั้งต้นอีกตัวหนึ่งได้รับ กล่าวกันว่าผู้บริจาคคู่อิเล็กตรอนจะถูกออกซิไดซ์และทำหน้าที่เป็นตัวรีดิวซ์ในขณะที่ผู้รับคู่อิเล็กตรอนจะลดลงเรียกว่าตัวออกซิไดซ์ ตัวอย่าง ได้แก่ ไซโตโครมออกซิเดสและแลคเตตดีไฮโดรจีเนส
- ทรานสเฟอร์เรส – เอ็นไซม์เหล่านี้เร่งความเร็วพร้อมกับการถ่ายโอนกลุ่มของอะตอม เช่น กลุ่มเมทิล (CH 3 ), อะเซทิล (CH 3 CO) หรืออะมิโน (NH 2 ) จากโมเลกุลหนึ่งไปยังอีกโมเลกุลหนึ่ง Acetate kinase และ alanine deaminase เป็นตัวอย่างของ Transferases
- ไฮโดรเลส – เอนไซม์เหล่านี้เร่งปฏิกิริยาไฮโดรไลซิส ปฏิกิริยาไฮโดรไลซิสใช้น้ำ (H 2 O) เพื่อแยกพันธะในโมเลกุลเพื่อสร้างผลิตภัณฑ์ลูกสาวสองคน โดยปกติโดยการติด -OH (กลุ่มไฮดรอกซิล) จากน้ำกับผลิตภัณฑ์ตัวใดตัวหนึ่งและ -H (อะตอมไฮโดรเจน) เดี่ยวกับ อื่น ๆ. ในระหว่างนี้ โมเลกุลใหม่จะถูกสร้างขึ้นจากอะตอมที่ถูกแทนที่โดยส่วนประกอบ -H และ -OH เอนไซม์ย่อยอาหารไลเปสและซูคราสเป็นไฮโดรเลส
- ไลเอส – เอ็นไซม์เหล่านี้ช่วยเพิ่มอัตราการเพิ่มกลุ่มโมเลกุลหนึ่งกลุ่มเป็นพันธะคู่หรือการกำจัดสองกลุ่มออกจากอะตอมใกล้เคียงเพื่อสร้างพันธะคู่ การกระทำเหล่านี้เหมือนไฮโดรเลส ยกเว้นว่าส่วนประกอบที่ถอดออกจะไม่ถูกแทนที่ด้วยน้ำหรือส่วนของน้ำ เอ็นไซม์ประเภทนี้ ได้แก่ ออกซาเลต ดีคาร์บอกซิเลส และ ไอโซซิเตรต ไลเดส
- ไอโซเมอเรส – เอ็นไซม์เหล่านี้เร่งปฏิกิริยาไอโซเมอไรเซชัน ปฏิกิริยาเหล่านี้เป็นปฏิกิริยาที่อะตอมดั้งเดิมทั้งหมดในสารตั้งต้นจะคงอยู่ แต่ถูกจัดเรียงใหม่เพื่อสร้างไอโซเมอร์ของสารตั้งต้น ไอโซเมอร์เป็นโมเลกุลที่มีสูตรทางเคมีเหมือนกัน แต่มีการจัดเรียงต่างกัน ตัวอย่าง ได้แก่ ไอโซเมอเรสกลูโคส-ฟอสเฟตและอะลานีนเรซเมส
- Ligases - เรียกอีกอย่างว่า synthetases เอนไซม์เหล่านี้ช่วยเพิ่มอัตราการรวมตัวกันของสองโมเลกุล พวกเขามักจะบรรลุสิ่งนี้โดยการใช้พลังงานที่ได้จากการสลายอะดีโนซีน ไตรฟอสเฟต (ATP) ตัวอย่างของลิกาสรวมถึงอะซิติล-CoA ซินธิเทสและดีเอ็นเอลิเกส

