Мета навчання
На цьому уроці ми будемо вчитися
- Що таке ферменти?
- Основні характеристики ферментів
- Як діють ферменти?
- Гіпотеза блокування та ключа
- Гіпотеза наведеної придатності
- Ключові фактори, що впливають на активність ферментів
- Шість різних типів ферментів
ЩО ТАКЕ ЕНЗИМИ?
Ферменти - це біологічні каталізатори, які прискорюють хімічні реакції, не змінюючись при цьому в процесі. Жива система контролює свою активність за допомогою ферментів.
Деякі приклади ферментів
- Лактаза - вона розщеплює лактозу на глюкозу та галактозу
- Каталаза - вона розщеплює перекис водню до води та кисню
- Глікогенсинтаза - каталізує утворення глікозидних зв’язків між молекулами глюкози
- АТФаза - вона розщеплює АТФ на АДФ, виробляючи енергію
ЯКІ ОСНОВНІ ХАРАКТЕРИСТИКИ ФЕРМЕНТІВ?
- Основна функція ферменту - збільшити швидкість реакції.
- Ферменти специфічні, тобто мають певну форму, тому лише певний субстрат буде відповідати його активному центру
- Ферменти регулюються від стану низької активності до високої активності і навпаки
ЯК ПРАЦЮЮТЬ ФЕРМЕНТИ?
Більшість реакцій в клітині вимагають дуже високих температур, щоб почати рух, що призведе до руйнування клітини. Ферменти працюють, знижуючи енергію активації реакції. Енергія активації реакції знижується, створюючи напругу на зв'язках у молекулі або утримуючи молекули близько. Це збільшує ймовірність реакції і тим самим знижує енергію, необхідну для її початку.
Молекула, з якою зв’язується фермент, називається субстратом. Субстрат зв'язується з невеликим відділом ферменту, який називається активним центром. Молекула, що утворюється в кінці реакції, називається «продуктом». Після завершення реакції фермент вивільняє продукт і готовий до зв’язування з іншим субстратом.
Існує дві теорії, що пояснюють дію ферменту
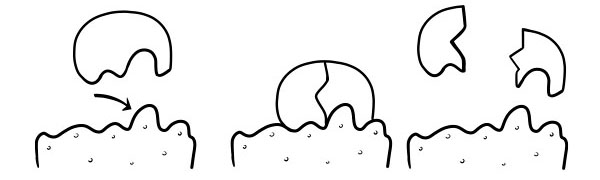
ТЕОРІЯ ЗАМІКІВ І КЛЮЧІВ
Вперше його постулював Еміль Фішер у 1894 році. Гіпотеза Лока та Ключа - це модель того, як ферменти каталізують субстратні реакції. У ньому зазначено, що форма активних центрів ферментів точно доповнює форму субстрату. Коли молекула субстрату стикається з ферментом, форма активного центру якого доповнює, субстрат вписується в активний центр і утворюється фермент-субстратний комплекс. Фермент буде каталізувати реакцію, а продукти разом з ферментом утворюватимуть ферментно-продуктовий комплекс. Згідно з цією моделлю фермент може каталізувати зворотну реакцію.
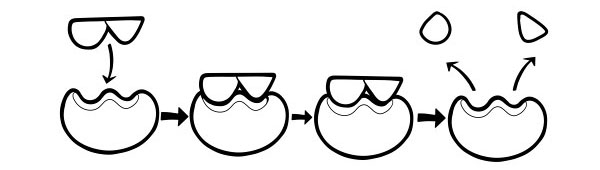
ІНДУКЦІЙНИЙ ГІПОТЕЗ
Це більш пізня і широко прийнята модель для опису роботи ферментів. У ній зазначається, що форма активних ділянок не є абсолютно взаємодоповнювальною, але змінює форму за наявності конкретного субстрату, щоб стати взаємодоповнюючими.
Коли молекула субстрату стикається з ферментом, якщо його склад є конкретно правильним, форма активного центру ферменту зміниться, так що субстрат впишеться в нього і може утворитися фермент-субстратний комплекс. Потім реакція каталізується і утворюється фермент-продуктовий комплекс.
ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА ЕНЗИМНУ ДІЯЛЬНІСТЬ
Середовище ферменту і субстрату може впливати на швидкість реакції. У деяких випадках навколишнє середовище може призвести до того, що фермент перестане працювати або навіть розкриється. Коли фермент перестає працювати, ми називаємо його «денатурованим».
Ось кілька факторів, які можуть вплинути на активність ферментів:
- Температура - температура може впливати на швидкість реакції. Чим вище температура, тим швидше відбуватиметься реакція. Однак або підвищення, або зниження температури поза допустимим діапазоном може вплинути на хімічні зв'язки в активному центрі, роблячи їх менш придатними для зв'язування субстратів. Дуже високі температури можуть спричинити денатурацію ферменту, втрачаючи форму та активність.
- рН - рН також може впливати на функцію ферменту. Амінокислотні залишки активного центру часто мають кислотні або основні властивості, важливі для каталізу. Зміни рН можуть вплинути на ці залишки та ускладнити зв’язування субстратів. Ферменти найкраще працюють у певному діапазоні рН, і як і при температурі, екстремальні значення рН (кислі або основні) можуть спричинити денатурацію ферментів.
- Концентрація ферментів і субстрату - Швидкість реакції зростає зі збільшенням концентрації субстрату до точки, після якої подальше збільшення концентрації субстрату не спричиняє значних змін швидкості реакції. Це відбувається тому, що після певної концентрації субстрату всі активні ділянки ферменту заповнені, і подальша реакція не може відбуватися.
- Інгібітори - інгібітори - це молекули, спеціально виготовлені для зупинки активності ферментів. Вони можуть просто уповільнити реакцію або взагалі зупинити її. Деякі інгібітори зв’язуються з ферментом, змушуючи його змінювати форму і не працювати належним чином. Протилежністю інгібітору є активатор, який може допомогти прискорити реакцію.
ВИДИ ФЕРМЕНТІВ
Людський організм складається з шести основних груп або класів ферментів:
- Оксидоредуктази - ці ферменти підсилюють швидкість реакцій окислення та відновлення. У цих реакціях, які також називають окислювально-відновними, один із реагентів віддає пару електронів, яку отримує інший реагент. Кажуть, що донор електронної пари окислюється і діє як відновник, тоді як реципієнт електронної пари відновлений називається окисником. Приклади включають цитохромоксидазу та лактатдегідрогеназу.
- Трансферази - ці ферменти пришвидшуються разом із перенесенням груп атомів, таких як метильна (CH 3 ), ацетильна (CH 3 CO) або аміно (NH 2 ) групи, від однієї молекули до іншої. Ацетаткіназа та аланіндеаміназа є прикладами трансфераз.
- Гідролази - ці ферменти прискорюють реакції гідролізу. У реакціях гідролізу вода (H 2 O) розщеплює зв'язок у молекулі, створюючи два дочірні продукти, як правило, шляхом приєднання -ОН (гідроксильної групи) з води до одного з продуктів та одного -Н (атома водню) до інші. Тим часом із атомів, витіснених компонентами -H та -OH, утворюється нова молекула. Травні ферменти ліпаза та сахараза є гідролазами.
- Ліази - ці ферменти підвищують швидкість додавання однієї молекулярної групи до подвійного зв’язку або видалення двох груп із сусідніх атомів, щоб створити подвійний зв’язок. Вони діють як гідролази, за винятком того, що видалений компонент не витісняється водою або частинами води. Цей клас ферментів включає оксалатдекарбоксилазу та ізоцитрат ліазу.
- Ізомерази - ці ферменти прискорюють реакції ізомеризації. Це реакції, в яких всі вихідні атоми в реагенті зберігаються, але переставляються, утворюючи ізомер реагенту. Ізомери - це молекули з однаковою хімічною формулою, але різним розташуванням. Приклади включають глюкозо-фосфат-ізомеразу та аланін-рацемазу.
- Лігази - ці ферменти, які також називаються синтетазами, посилюють швидкість з’єднання двох молекул. Зазвичай вони досягають цього, використовуючи енергію, отриману в результаті розпаду аденозинтрифосфату (АТФ). Приклади лігаз включають ацетил-КоА-синтетазу та ДНК-лігазу.

