O‘quv maqsadlari
Ushbu darsda biz o'rganamiz
- Fermentlar nima?
- Fermentlarning asosiy xarakteristikalari
- Fermentlar qanday ishlaydi?
- Qulf va kalit gipotezasi
- Induced-Fit gipotezasi
- Ferment faolligiga ta'sir qiluvchi asosiy omillar
- Olti xil turdagi fermentlar
FERMENTLAR NIMALAR?
Fermentlar kimyoviy reaktsiyalarni tezlashtiradigan biologik katalizatorlar bo'lib, ular jarayonda o'zgarmasdir. Tirik tizim o'z faoliyatini fermentlar orqali boshqaradi.
Fermentlarga ba'zi misollar
- Laktaza - laktozani glyukoza va galaktozaga ajratadi
- Katalaza - vodorod periksni suv va kislorodga parchalaydi
- Glikogen sintaza - glyukoza molekulalari o'rtasida glikozid aloqalarining shakllanishini katalizlaydi.
- ATPaz - ATPni ADP ga parchalab, energiya ishlab chiqaradi
FERMENTLARNING ASOSIY XUSUSIYATLARI QANDAY?
- Fermentning asosiy vazifasi reaksiya tezligini oshirishdir.
- Fermentlar o'ziga xosdir, ya'ni ular o'ziga xos shaklga ega, shuning uchun faqat ma'lum bir substrat uning faol joyiga mos keladi
- Fermentlar past faollik holatidan yuqori faollikgacha va aksincha tartibga solinadi
FERMENTLAR QANDAY ISHLATILADI?
Hujayradagi ko'pgina reaktsiyalar juda yuqori haroratni talab qiladi, bu esa hujayrani yo'q qiladi. Fermentlar reaksiyaning faollashuv energiyasini kamaytirish orqali ishlaydi. Reaksiyaning faollashuv energiyasi molekula ichidagi bog'lanishlarga stress qo'yish yoki molekulalarni bir-biriga yaqin tutish orqali kamayadi. Bu reaktsiya ehtimolini oshiradi va shuning uchun uni boshlash uchun zarur bo'lgan energiyani kamaytiradi.
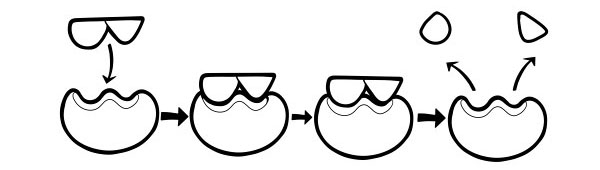
Ferment bog'langan molekula substrat deb ataladi. Substrat faol joy deb ataladigan fermentning kichik qismiga bog'lanadi. Reaksiya oxirida hosil bo'lgan molekula "mahsulot" deb ataladi. Reaksiya tugagach, ferment mahsulotni chiqaradi va boshqa substrat bilan bog'lanishga tayyor bo'ladi.
Ferment ta'sirini tushuntirish uchun ikkita nazariya mavjud
QULF VA KALIT NAZARIYASI
Bu birinchi marta 1894 yilda Emil Fisher tomonidan ilgari surilgan. Qulf va kalit gipotezasi fermentlarning substrat reaksiyalarini qanday katalizlashi modelidir. U fermentlarning faol joylarining shakli substratning shakliga to'liq mos kelishini bildiradi. Substrat molekulasi faol joy shakli bir-birini to'ldiruvchi ferment bilan to'qnashganda, substrat faol maydonga joylashadi va ferment-substrat kompleksi hosil bo'ladi. Ferment reaksiyani katalizlaydi va mahsulotlar ferment bilan birgalikda ferment-mahsulot kompleksini hosil qiladi. Ushbu modelga ko'ra, ferment teskari reaktsiyani katalizlashi mumkin.
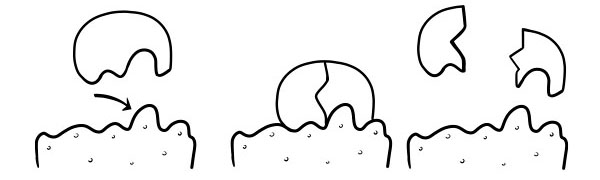
INDUCED-FIT GIPOTEZASI
Bu fermentlarning ishlash usulini tasvirlash uchun eng yangi va keng tarqalgan model. Unda aytilishicha, faol saytlarning shakli bir-birini to'liq to'ldirmaydi, balki bir-birini to'ldiruvchi bo'lish uchun ma'lum bir substrat mavjudligida shaklini o'zgartiradi.
Substrat molekulasi ferment bilan to'qnashganda, agar uning tarkibi maxsus to'g'ri bo'lsa, fermentning faol joyining shakli o'zgaradi, shunda substrat uning ichiga sig'adi va ferment-substrat kompleksi hosil bo'lishi mumkin. Keyin reaksiya katalizlanadi va ferment-mahsulot kompleksi hosil bo'ladi.
FERMENTLAR FAOLIYATIGA TA'sir etuvchi OMILLAR
Ferment va substratning muhiti reaksiya tezligiga ta'sir qilishi mumkin. Ba'zi hollarda atrof-muhit fermentning ishlamay qolishiga yoki hatto parchalanishiga olib kelishi mumkin. Ferment ishlashni to'xtatganda, biz uni "denaturatsiyalangan" deb ataymiz.
Ferment faolligiga ta'sir qiluvchi ba'zi omillar:
- Harorat - harorat reaktsiya tezligiga ta'sir qilishi mumkin. Harorat qanchalik yuqori bo'lsa, reaktsiya tezroq sodir bo'ladi. Biroq, ruxsat etilgan diapazondan tashqarida haroratni oshirish yoki kamaytirish faol maydondagi kimyoviy bog'lanishlarga ta'sir qilishi mumkin, bu ularni substratlarni bog'lash uchun kamroq mos keladi. Juda yuqori haroratlar fermentning denatüratsiyasiga, shakli va faolligini yo'qotishiga olib kelishi mumkin.
- pH - pH ham ferment funktsiyasiga ta'sir qilishi mumkin. Faol aminokislota qoldiqlari ko'pincha kataliz uchun muhim bo'lgan kislotali yoki asosiy xususiyatlarga ega. PH ning o'zgarishi bu qoldiqlarga ta'sir qilishi va substratlarning bog'lanishini qiyinlashtirishi mumkin. Fermentlar ma'lum bir pH oralig'ida eng yaxshi ishlaydi va haroratda bo'lgani kabi, haddan tashqari pH qiymatlari (kislotali yoki asosiy) fermentlarni denatüratsiya qilishi mumkin.
- Fermentlar va substrat kontsentratsiyasi - Reaksiya tezligi substrat kontsentratsiyasining ortishi bilan bir nuqtaga ko'tariladi, undan keyin substrat kontsentratsiyasining har qanday oshishi reaktsiya tezligida sezilarli o'zgarishlarga olib kelmaydi. Buning sababi, substratning ma'lum bir kontsentratsiyasidan so'ng, fermentdagi barcha faol joylar to'la bo'ladi va boshqa reaktsiya bo'lmaydi.
- Inhibitorlar - Inhibitorlar fermentlar faoliyatini to'xtatish uchun maxsus ishlab chiqarilgan molekulalardir. Ular reaktsiyani sekinlashtirishi yoki butunlay to'xtatishi mumkin. Ba'zi inhibitorlar ferment bilan bog'lanib, uning shakli o'zgarishiga olib keladi va to'g'ri ishlamaydi. Inhibitorning qarama-qarshi tomoni reaksiyani tezlashtirishga yordam beradigan faollashtiruvchi vositadir.
FERMENTLARNING TURLARI
Inson tanasi oltita asosiy guruh yoki fermentlar sinfidan iborat:
- Oksidoredduktazlar - bu fermentlar oksidlanish va qaytarilish reaktsiyalarining tezligini oshiradi. Ushbu reaktsiyalarda, shuningdek, oksidlanish-qaytarilish reaktsiyalari deb ataladi, reaktivlardan biri boshqa reaktiv olgan elektron juftligini beradi. Elektron juft donor oksidlanadi va qaytaruvchi vazifasini bajaradi, qaytaruvchi elektron jufti esa oksidlovchi deb ataladi. Masalan, sitoxrom oksidaza va laktat dehidrogenaza.
- Transferazalar - bu fermentlar metil (CH 3 ), atsetil (CH 3 CO ) yoki amino (NH 2 ) guruhlari kabi atomlar guruhlarini bir molekuladan boshqa molekulaga o'tkazish bilan birga tezlashadi. Asetat kinaz va alanin deaminaza transferazlarga misol bo'la oladi.
- Gidrolazalar - bu fermentlar gidroliz reaktsiyalarini tezlashtiradi. Gidroliz reaktsiyalarida molekuladagi bog'lanishni ajratish uchun suvdan (H 2 O) foydalanadi, odatda ikkita mahsulot hosil qiladi, odatda suvdan -OH (gidroksil guruhi) ni mahsulotlardan biriga va bitta -H (vodorod atomi) ni biriktiradi. boshqa. Bu orada -H va -OH komponentlari bilan almashtirilgan atomlardan yangi molekula hosil bo'ladi. Lipaza va saxaroza ovqat hazm qilish fermentlari gidrolazalardir.
- Liazalar - bu fermentlar qo'sh bog'lanishga bir molekulyar guruhning qo'shilish tezligini yoki qo'sh aloqani yaratish uchun yaqin atrofdagi atomlardan ikkita guruhni olib tashlash tezligini oshiradi. Ular gidrolazalar kabi ishlaydi, faqat olib tashlangan komponent suv yoki suv qismlari bilan almashtirilmaydi. Bu fermentlar sinfiga oksalat dekarboksilaza va izotsitrat liaz kiradi.
- Izomerazlar - bu fermentlar izomerizatsiya reaktsiyalarini tezlashtiradi. Bu reaksiyaga kirishuvchining barcha dastlabki atomlari saqlanib qoladigan, lekin reaktivning izomerini hosil qilish uchun qayta tartibga solingan reaksiyalardir. Izomerlar bir xil kimyoviy formulaga ega bo'lgan, ammo turli xil tartibga ega bo'lgan molekulalardir. Masalan, glyukoza-fosfat izomeraza va alanin rasemaza.
- Ligazalar - Sintetazalar deb ham ataladigan bu fermentlar ikkita molekulaning qo'shilish tezligini oshiradi. Ular buni odatda adenozin trifosfat (ATP) parchalanishidan olingan energiyadan foydalanish orqali amalga oshiradilar. Ligazalarga misol sifatida atsetil-KoA sintetaza va DNK ligaza kiradi.

