Mục tiêu học tập
Trong bài học này, chúng ta sẽ học
- Enzyme là gì?
- Đặc điểm chính của enzym
- Enzyme hoạt động như thế nào?
- Giả thuyết về khóa và chìa khóa
- Giả thuyết phù hợp cảm ứng
- Các yếu tố chính ảnh hưởng đến hoạt động của enzym
- Sáu loại enzym khác nhau
ENZYMES LÀ GÌ?
Enzyme là chất xúc tác sinh học giúp tăng tốc độ phản ứng hóa học mà bản thân chúng không bị thay đổi trong quá trình này. Một hệ thống sống kiểm soát hoạt động của nó thông qua các enzym.
Một số ví dụ về enzym là
- Lactase - Nó phân hủy Lactose thành Glucose và Galactose
- Catalase - Nó phá vỡ hydrogen peroxide thành nước và oxy
- Glycogen synthase - Nó xúc tác sự hình thành các liên kết glycosidic giữa các phân tử glucose
- ATPase - Nó phân hủy ATP thành ADP, tạo ra năng lượng
CÁC ĐẶC ĐIỂM CHÍNH CỦA ENZYMES LÀ GÌ?
- Chức năng cơ bản của enzym là tăng tốc độ phản ứng.
- Enzyme là cụ thể tức là chúng có hình dạng cụ thể, do đó chỉ một cơ chất nhất định sẽ phù hợp với vị trí hoạt động của nó
- Enzim được điều hòa từ trạng thái hoạt động thấp sang trạng thái hoạt động cao và ngược lại
ENZYMES HOẠT ĐỘNG NHƯ THẾ NÀO?
Hầu hết các phản ứng trong tế bào đòi hỏi nhiệt độ rất cao để diễn ra, điều này sẽ phá hủy tế bào. Enzyme hoạt động bằng cách giảm năng lượng hoạt hóa của phản ứng. Năng lượng hoạt hóa của một phản ứng được hạ thấp bằng cách gây áp lực lên các liên kết trong phân tử, hoặc bằng cách giữ các phân tử lại gần nhau. Điều này làm tăng khả năng xảy ra phản ứng và do đó làm giảm năng lượng cần thiết để bắt đầu phản ứng.
Phân tử mà enzyme liên kết được gọi là cơ chất. Cơ chất liên kết với một phần nhỏ của enzym được gọi là vị trí hoạt động. Phân tử được tạo ra ở cuối phản ứng được gọi là 'sản phẩm'. Khi phản ứng hoàn tất, enzyme giải phóng sản phẩm và sẵn sàng liên kết với cơ chất khác.
Có hai lý thuyết để giải thích hoạt động của enzyme
LÝ THUYẾT KHÓA VÀ CHÌA KHÓA
Nó được công nhận lần đầu tiên vào năm 1894 bởi Emil Fischer. Giả thuyết Khóa và Chìa khóa là một mô hình về cách các enzym xúc tác các phản ứng cơ chất. Nó cho biết hình dạng của các vị trí hoạt động của các enzym hoàn toàn bổ sung cho hình dạng của chất nền. Khi một phân tử cơ chất va chạm với một enzym có hình dạng vị trí hoạt động là bổ sung, cơ chất sẽ phù hợp với vị trí hoạt động và một phức hợp enzym-cơ chất sẽ hình thành. Enzyme sẽ xúc tác cho phản ứng, và các sản phẩm cùng với enzyme sẽ tạo thành phức hợp enzyme-sản phẩm. Theo mô hình này, có thể cho một enzym xúc tác phản ứng ngược.
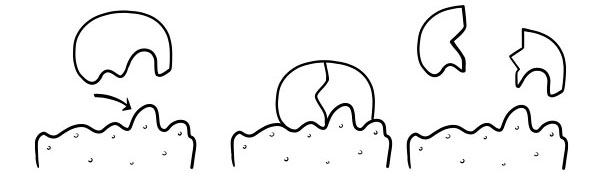
GIẢ THUYẾT INDUCED-FIT
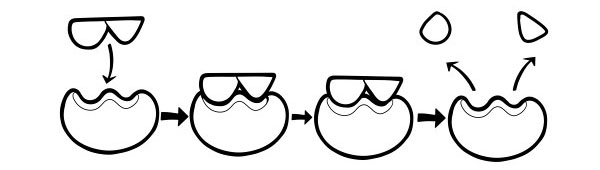
Đây là một mô hình gần đây hơn và được chấp nhận rộng rãi hơn để mô tả cách thức hoạt động của các enzym. Nó nói rằng hình dạng của các vị trí hoạt động không phải là bổ sung chính xác mà thay đổi hình dạng khi có một chất nền cụ thể để trở thành bổ sung.
Khi một phân tử cơ chất va chạm với một enzim, nếu thành phần của nó chính xác một cách cụ thể, thì hình dạng của vị trí hoạt động của enzim sẽ thay đổi để cơ chất phù hợp với nó và phức hợp enzim - cơ chất có thể hình thành. Phản ứng sau đó được xúc tác và tạo thành phức hợp enzyme-sản phẩm.
CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN HOẠT ĐỘNG ENZYME
Môi trường của enzym và cơ chất có thể ảnh hưởng đến tốc độ của phản ứng. Trong một số trường hợp, môi trường có thể làm cho enzym ngừng hoạt động hoặc thậm chí không hoạt động. Khi một enzym ngừng hoạt động, chúng ta gọi nó là "biến tính".
Dưới đây là một số yếu tố có thể ảnh hưởng đến hoạt động của enzym:
- Nhiệt độ - Nhiệt độ có thể ảnh hưởng đến tốc độ phản ứng. Nhiệt độ càng cao thì phản ứng xảy ra càng nhanh. Tuy nhiên, việc tăng hoặc giảm nhiệt độ ngoài phạm vi cho phép có thể ảnh hưởng đến các liên kết hóa học trong vị trí hoạt động, làm cho chúng kém phù hợp hơn để liên kết với chất nền. Nhiệt độ quá cao có thể làm biến tính enzym, mất hình dạng và hoạt tính.
- pH - pH cũng có thể ảnh hưởng đến chức năng của enzym. Các gốc axit amin ở vị trí hoạt động thường có tính chất axit hoặc bazơ rất quan trọng đối với xúc tác. Sự thay đổi độ pH có thể ảnh hưởng đến các chất cặn này và làm cho các chất nền khó kết dính. Enzyme hoạt động tốt nhất trong một phạm vi pH nhất định, và cũng như với nhiệt độ, các giá trị pH quá cao (có tính axit hoặc bazơ) có thể làm biến tính các enzyme.
- Nồng độ của enzym và cơ chất - Tốc độ phản ứng tăng khi nồng độ cơ chất tăng lên đến một điểm, vượt quá mức tăng nồng độ cơ chất sẽ không làm thay đổi đáng kể tốc độ phản ứng. Điều này xảy ra vì sau một nồng độ nhất định của cơ chất, tất cả các vị trí hoạt động trên enzyme đã đầy đủ và không thể xảy ra phản ứng nào nữa.
- Chất ức chế - Chất ức chế là các phân tử được chế tạo đặc biệt để ngăn chặn hoạt động của các enzym. Họ có thể chỉ làm chậm phản ứng hoặc dừng hoàn toàn. Một số chất ức chế liên kết với enzyme khiến nó thay đổi hình dạng và không hoạt động chính xác. Ngược lại với chất ức chế là chất hoạt hóa có thể giúp đẩy nhanh phản ứng.
CÁC LOẠI ENZYMES
Cơ thể con người bao gồm sáu nhóm hoặc lớp enzyme chính:
- Oxidoreductases - Những enzym này tăng cường tốc độ của các phản ứng oxy hóa và khử. Trong những phản ứng này, còn được gọi là phản ứng oxy hóa khử, một trong những chất phản ứng nhường một cặp electron mà chất phản ứng khác nhận được. Chất cho cặp electron được cho là chất oxi hóa và hoạt động như một chất khử, trong khi chất nhận cặp electron bị khử được gọi là chất oxi hóa. Ví dụ bao gồm cytochrome oxidase và lactate dehydrogenase.
- Transferase - Các enzym này tăng tốc cùng với việc chuyển các nhóm nguyên tử, chẳng hạn như nhóm methyl (CH 3 ), acetyl (CH 3 CO) hoặc amino (NH 2 ), từ phân tử này sang phân tử khác. Acetate kinase và alanin deaminase là những ví dụ về transferase.
- Hydrolase - Những enzym này đẩy nhanh phản ứng thủy phân. Phản ứng thủy phân sử dụng nước (H 2 O) để tách một liên kết trong phân tử để tạo ra hai sản phẩm con, thường bằng cách gắn -OH (nhóm hydroxyl) từ nước thành một trong các sản phẩm và một -H (nguyên tử hydro) duy nhất thành cai khac. Trong khi đó, một phân tử mới được hình thành từ các nguyên tử bị thay thế bởi các thành phần -H và -OH. Các enzym tiêu hóa lipase và sucrase là các hydrolase.
- Lyases - Những enzym này tăng cường tốc độ bổ sung một nhóm phân tử vào một liên kết đôi hoặc loại bỏ hai nhóm từ các nguyên tử lân cận để tạo ra một liên kết đôi. Chúng hoạt động giống như hydrolase, ngoại trừ việc thành phần bị loại bỏ không bị nước hoặc các phần của nước thay thế. Nhóm enzym này bao gồm oxalat decarboxylase và isocitrate lyase.
- Isomerase - Các enzym này tăng tốc độ phản ứng đồng phân hóa. Đây là những phản ứng trong đó tất cả các nguyên tử ban đầu trong chất phản ứng được giữ lại, nhưng được sắp xếp lại để tạo thành đồng phân của chất phản ứng. Đồng phân là những phân tử có cùng công thức hóa học, nhưng cách sắp xếp khác nhau. Ví dụ bao gồm glucose-phosphate isomerase và alanin racemase.
- Chất thắt - Còn được gọi là synthetases, những enzym này tăng cường tốc độ liên kết của hai phân tử. Họ thường thực hiện điều này bằng cách sử dụng năng lượng có được từ sự phân hủy adenosine triphosphate (ATP). Ví dụ về ligase bao gồm acetyl-CoA synthetase và DNA ligase.

