هناك ثلاثة قوانين أساسية للغاز (قانون بويل وقانون تشارلز وقانون أفوجادرو) التي تصف العلاقة بين الضغط ودرجة الحرارة والحجم وكمية الغاز. سنناقش في هذا الدرس ما يلي
سميت على اسم روبرت بويل.
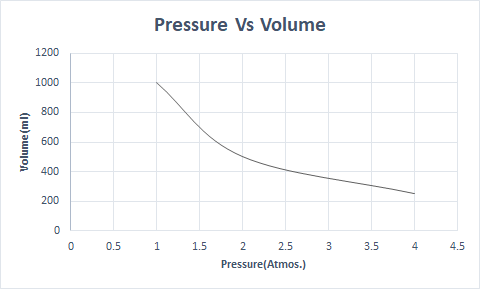
يوضح هذا أن الحجم يتناسب عكسياً مع الضغط عندما تكون درجة الحرارة وعدد الجزيئات ثابتًا.
\(P ∝ 1/V\)
\(P = k_1V\)
أين،
P هو الضغط
V هو الحجم
و k 1 هو ثابت التناسب
الآن ، إذا تعرضت كتلة ثابتة من الغاز للتمدد عند درجة حرارة ثابتة ، فيجب أن يكون الحجم والضغط النهائيان P 2 و V 2 .
الحجم الأولي والضغط الأولي هنا هو P 1 و V 1 ، ثم وفقًا لقانون بويل:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
وهكذا ، عند درجة حرارة ثابتة ، إذا تضاعف الضغط ، ينخفض حجم هذا الغاز إلى النصف. في الحالة الحرة ، تحتل المادة الغازية حجمًا أكبر من الحاوية بسبب الجزيئات المتناثرة. عندما يتم الضغط على المادة الغازية ، تقترب هذه الجزيئات وتحتل حجمًا أقل. بمعنى آخر ، الضغط المطبق يتناسب طرديًا مع كثافة الغاز.
فيما يلي تمثيل رسومي لقانون بويل:
في المرتفعات العالية ، يكون الضغط الجوي منخفضًا وبالتالي يكون الهواء أقل كثافة. نتيجة لذلك ، يتوفر أكسجين أقل للتنفس. هذا هو سبب حمل متسلقي الجبال لأسطوانات الأكسجين.
في عام 1787 ، درس جاك تشارلز تأثير درجة الحرارة على حجم مادة غازية عند ضغط ثابت. ينص قانون تشارلز على أنه عند الضغط المستمر والكتلة الثابتة ، فإن حجم الغاز يتناسب طرديًا مع درجة الحرارة.
\(V ∝ T\)
\(V = yT\)
حيث y هو ثابت حسب كمية الغاز والضغط.
يتم التعبير عن قانون تشارلز على النحو التالي:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
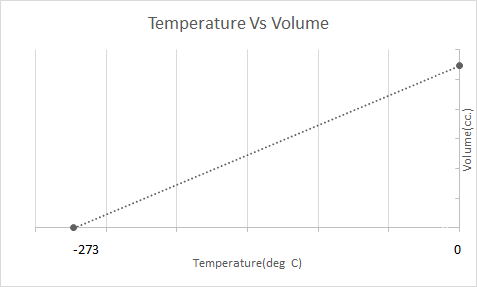
هذا يعني أنه مع زيادة درجة الحرارة يجب أن يزداد الحجم ؛ مع انخفاض درجة الحرارة ، ينخفض الحجم. في تجربته ، حسب أن حجم كتلة معينة من الغاز يزيد أو ينقص بمقدار 1 / 273.15 مرة من الحجم الأصلي مع كل درجة ارتفاع أو انخفاض في درجة الحرارة على التوالي.
لذلك ، إذا كان الحجم V 0 عند 0 O C و V t هو الحجم عند t o C ،
\(V_t = V_0 + \frac{t}{273.15} V_0\)
هذا هو التمثيل الرسومي لقانون تشارلز:
تعمل بالونات الهواء الساخن على أساس قانون تشارلز. عندما يسخن الموقد الهواء المحبوس داخل البالون ، تبدأ جزيئات الهواء في التحرك بشكل أسرع وتتوسع. يشغل الغاز داخل البالون مساحة أكبر ، ويصبح أقل كثافة من الهواء المحيط به. عندما يصبح منطاد الهواء الساخن أقل كثافة ، يرتفع ويطفو.
يُعرف هذا أيضًا باسم قانون الضغط. صاغه جوزيف لويس جاي لوساك في عام 1808.
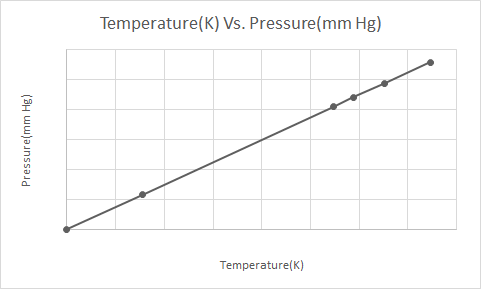
ينص قانون جاي لوساك على أنه عند الحجم الثابت ، يتناسب ضغط الغاز المثالي طرديًا مع درجة حرارته المطلقة (بالكلفن).
\(P ∝ T\)
\(P/T = k \)
أين
يمكن التعبير عن قانون جاي لوساك على النحو التالي:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
أين:
وفقًا لقانون جاي-لوساك ، فإن ضغط الغاز (الذي يتم الاحتفاظ به في حجم ثابت) ينخفض باستمرار حيث يتم تبريده حتى يتكثف الغاز في النهاية ويصبح سائلًا.
هذا هو التمثيل الرسومي لقانون جاي-لوساك
عندما يتم تسخين عبوة بخاخ مضغوط (مثل علبة مزيل العرق أو علبة طلاء بخاخ) ، يمكن أن تؤدي الزيادة الناتجة في الضغط الذي تمارسه الغازات الموجودة على الحاوية إلى حدوث انفجار. هذا هو السبب في أن العديد من الحاويات المضغوطة تحتوي على ملصقات تحذيرية تنص على ضرورة إبقاء الحاوية بعيدًا عن النار وتخزينها في بيئة باردة.
عندما يتم تسخين قدر الضغط ، يزداد الضغط الذي يمارسه البخار داخل الحاوية. يؤدي ارتفاع درجة الحرارة والضغط داخل الحاوية إلى طهي الطعام بشكل أسرع.