Qazın təzyiqi, temperaturu, həcmi və miqdarının əlaqəsini təsvir edən üç əsas qaz qanunu (Boyl qanunu, Çarlz qanunu və Avoqadro qanunu) mövcuddur. Bu dərsdə biz aşağıdakıları müzakirə edəcəyik
Robert Boylin adını daşıyır.
Bu, temperatur və molekulların sayı sabit olduqda həcmin təzyiqlə tərs mütənasib olduğunu bildirir.
\(P ∝ 1/V\)
\(P = k_1V\)
harada,
P təzyiqdir
V Həcmdir
və, k 1 mütənasiblik sabitidir
İndi, sabit bir qaz kütləsi sabit temperaturda genişlənməyə məruz qalırsa, son həcm və təzyiq P 2 və V 2 olacaqdır.
Burada ilkin həcm və ilkin təzyiq P 1 və V 1 , sonra Boyl qanununa görə:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Beləliklə, sabit bir temperaturda təzyiq iki dəfə artırıldıqda, həmin qazın həcmi yarıya qədər azalır. Sərbəst vəziyyətdə qaz halında olan maddə səpələnmiş molekullara görə qabın daha böyük həcmini tutur. Qaz halında olan maddəyə təzyiq tətbiq edildikdə, bu molekullar yaxınlaşır və daha az həcm tutur. Başqa sözlə, tətbiq olunan təzyiq qazın sıxlığı ilə düz mütənasibdir.
Boyl qanununun qrafik təsviri:
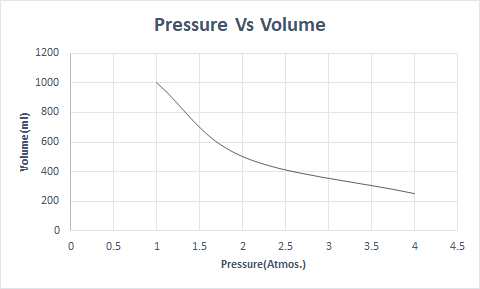
Yüksək hündürlükdə atmosfer təzyiqi aşağıdır, buna görə də hava daha az sıx olur. Nəticədə nəfəs almaq üçün daha az oksigen mövcuddur. Alpinistlərin oksigen balonlarını daşımasının səbəbi də budur.
1787-ci ildə Jak Çarlz sabit təzyiqdə qaz halında olan maddənin həcminə temperaturun təsirini tədqiq etdi. Çarlz qanununda deyilir ki, sabit təzyiq və sabit kütlədə qazın həcmi temperaturla düz mütənasibdir.
\(V ∝ T\)
\(V = yT\)
Burada y qazın miqdarından və təzyiqindən asılı olaraq sabitdir.
Çarlz qanunu belə ifadə edilir:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Bu o deməkdir ki, temperaturun artması ilə həcm artacaq; temperaturun azalması ilə həcm azalır. O, öz təcrübəsində hesablamışdır ki, qazın verilmiş kütləsinin həcmi müvafiq olaraq temperaturun hər dərəcə yüksəlməsi və ya azalması ilə ilkin həcmdən 1/273,15 dəfə artıb və ya azalır.
Deməli, əgər 0 O C-də həcm V 0 , V t isə t o C-də həcmdirsə, onda,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Budur Çarlz Qanununun qrafik təsviri:
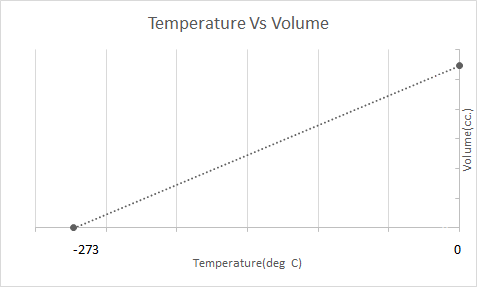
İsti hava şarları Çarlz Qanunu əsasında işləyir. Brülör şarın içində sıxılmış havanı qızdırdıqda, hava molekulları daha sürətli hərəkət etməyə başlayır və genişlənir. Balonun içindəki qaz daha çox yer tutur və onu əhatə edən havadan daha az sıx olur. İsti hava balonu daha az sıxlaşdıqca yuxarı qalxır və üzür.
Bu həm də Təzyiq Qanunu kimi tanınır. 1808-ci ildə Cozef Lui Qey-Lussak tərəfindən tərtib edilmişdir.
Gey Lussak qanunu bildirir ki, sabit həcmdə ideal qazın təzyiqi onun mütləq temperaturu ilə düz mütənasibdir (Kelvin ilə).
\(P ∝ T\)
\(P/T = k \)
harada
Gey-Lussac qanunu aşağıdakı kimi ifadə edilə bilər:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Harada:
Gay-Lussac qanununa görə, qazın təzyiqi (sabit həcmdə saxlanılır) qaz nəhayət kondensasiyaya məruz qalana və maye halına gələnə qədər soyuduqca daim azalır.
Budur Gay-Lussac Qanununun qrafik təsviri
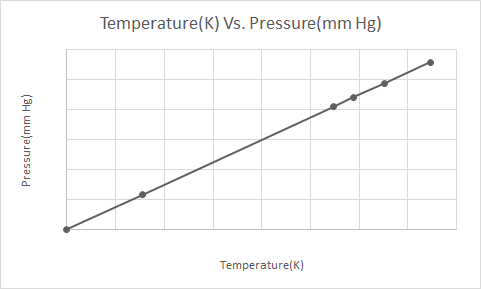
Təzyiqli aerozol qutusu (məsələn, dezodorant qutusu və ya sprey boya qabı) qızdırıldıqda, qazların konteynerə vurduğu təzyiqin artması partlayışla nəticələnə bilər. Bu səbəbdən bir çox təzyiqli qablarda qabın yanğından uzaq və sərin bir mühitdə saxlanması lazım olduğunu bildirən xəbərdarlıq etiketləri var.
Təzyiqli ocağı qızdırdıqda, buxarın qabın içindəki təzyiqi artır. Qabın içindəki yüksək temperatur və təzyiq yeməyin daha tez bişməsinə səbəb olur.